2016年湖北省咸宁市中考化学试卷
下列物质的用途是由其物理性质决定的是( )
| A. |
氧气用于气焊 |
B. |
酒精用作燃料 |
| C. |
金刚石用来裁玻璃 |
D. |
熟石灰改良酸性土壤 |
"上善若水,水善利万物而不争"。下列有关水的说法不正确的是( )
| A. |
地球上可供利用的淡水资源缺乏 |
B. |
水是由氢分子和氧原子组成的 |
| C. |
生活中通过煮沸可将降低水的硬度 |
D. |
自然界中的水都是混合物 |
下列关于碳和碳的氧化物的说法中,不正确的是( )
| A. |
活性炭可以除去冰箱中的异味 |
| B. |
可以利用CO的还原性炼铁 |
| C. |
CO 2可作为大棚种植农作物的气体肥料 |
| D. |
金刚石、石墨和C 60都是由碳原子构成的,性质相同 |
下列比较中,符合实际的是( )
| A. |
黄铜片比纯铜片的硬度大 |
B. |
地壳中硅的含量比氧多 |
| C. |
铁门窗比铝合金门窗更耐腐蚀 |
D. |
食盐水比食醋的pH小 |
金属R放入稀硫酸中,没有气泡产生,放入硫酸铜溶液中,表面有红色物质析出.下列关于R的金属活动性判断不正确的是( )
| A. |
R>Cu |
B. |
R>Fe |
C. |
Zn>R |
D. |
R>Ag |
下列实验设计能达到实验目的是( )

| A. |
图1探究可燃物燃烧的条件 |
B. |
图2探究分子运动现象 |
| C. |
图3验证甲烷燃烧生成CO 2和H 2O |
D. |
图4探究质量守恒定律 |
2015年10月,中国科学家屠呦呦获得诺贝尔医学或生理学奖,她是第一个发现青蒿素对疟疾寄生虫有出色疗效的科学家,这一发现在全球范围内挽救了数以百万人的生命.青蒿素的化学式为C 15H 22O 5,下列有关青蒿素的说法正确的是( )
| A. |
青蒿素属于有机物,由42个原子组成 |
| B. |
青蒿素的相对分子质量是280 |
| C. |
青蒿素中氧元素的质量分数最小 |
| D. |
青蒿素中C.H.O三种元素的质量比为90:11:40 |
化学反应依据不同的分类标准可分为不同类型.反应前后有元素化合价变化的化学反应是氧化还原反应.酸雨形成的原因主要有两种:
①3NO 2+H 2O═2HNO 3+X ②2SO 2+O 2+2H 2O  2H 2SO 4,下列说法不正确的是( )
2H 2SO 4,下列说法不正确的是( )
| A. |
反应①中X的化学式为NO |
B. |
反应①、②都属于氧化还原反应 |
| C. |
反应①、②中涉及的氧化物共有5种 |
D. |
化石燃料的燃烧是导致酸雨的"罪魁" |
列表和作图是常用的数据处理方法。结合所绘图表判断下列说法正确的是( )
氢氧化钠、碳酸钠分别在水、酒精中的溶解度
氢氧化钠 |
碳酸钠 |
|||
20℃ |
40℃ |
20℃ |
40℃ |
|
水 |
109g |
129g |
21.8g |
49g |
酒精 |
17.3g |
40g |
不溶 |
不溶 |

| A. |
图象与表格均能反映温度对固体物质溶解度的影响,其中表格的优点是变化规律更直观 |
| B. |
由表格数据可知,物质的溶解度只受温度影响 |
| C. |
40℃时,将50g NaOH分别投入到100g水和酒精中都能得到饱和溶液 |
| D. |
40℃时,将CO 2通入饱和的NaOH酒精溶液中有沉淀生成 |
分离、除杂、提纯和检验是化学实验的重要环节,下面实验设计能达到实验目的是( )
实验内容 |
实验设计 |
|
A |
除去CO 2中少量水蒸气、HCl气体 |
先通过浓硫酸、再通过NaOH溶液 |
B |
除去NaCl中难溶性杂质 |
溶解、过滤、蒸发 |
C |
除去KCl溶液中少量的K 2CO 3 |
加入适量Ca(NO 3) 2溶液、过滤 |
D |
鉴别氯化铵、尿素和氯化钾三种化肥 |
取样、加入熟石灰粉末、研磨 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
请用化学用语填空.
(1)2个氮分子 .
(2)某微粒的结构示意图为 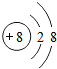 ,该微粒的符号是 .
,该微粒的符号是 .
(3)保持氧气化学性质的最小微粒 .
化学与生活密切相关.请回答下列问题.
(1)成语"釜底抽薪"运用的灭火原理是 .
(2)饮食均衡,身体不能健康.食用蔬菜、水果能获取的基本营养素主要是 .
(3)氢气是最清洁的能源,其原因是 (用化学方程式表示).
(4)生产中需要用15kg质量分数为16%的氯化钠溶液选种、需要氯化钠的质量是 kg.
如图是初中化学常见气体的发生装置,根据要求回答下列问题。

(1)仪器a的名称是 。
(2)实验室制取二氧化碳的化学方程式是 。用F来测量生成二氧化碳的体积,其中在水面上放一层植物油的目的是 。
(3)实验室用高锰酸钾制取氧气所选用的发生装置是 (填序号),该反应的基本反应类型为 。用E装置收集氧气时,观察到导管口的气泡 ,再把导管口伸入盛满水的集气瓶。
某金属冶炼厂在生产过程中产生了一定量的含铜废料。化学兴趣小组利用稀硫酸和铁粉分离回收铜,并获得硫酸亚铁晶体。其设计方案如图1所示。

查阅资料得知:在通入空气并加热的条件下,铜可与稀硫酸反应转化为硫酸铜,反应的化学方程式:2Cu+2H 2SO 4+O 2  2CuSO 4+2H 2O。
2CuSO 4+2H 2O。
(1)步骤Ⅰ中分离得到固体A和蓝色溶液B的操作名称是 。
(2)蓝色溶液B中的溶质是 (填化学式)。
(3)写出步骤Ⅲ中发生反应的化学方程式 。
(4)硫酸亚铁可用作治疗 (选填"贫血症"或"佝偻病")的药物。
(5)铜制品在空气中会发生锈蚀[铜锈的主要成分是Cu 2(OH) 2CO 3].根据铜锈的主要成分中含有氢元素和碳元素,可以判断出铜锈需要空气中的 (填化学式).若要探究"铜生锈是否需要空气中的氧气?"如图2所示实验中,只需完成 (填字母)两个实验即可达到实验目的。
实验室有一包白色粉末,可能含有CaCO 3、BaCl 2、Na 2SO 4、NaOH和NaCl中的一种或几种,为了确定其成分,某化学兴趣小组进行了如下探究。
实验前小组同学对五种物质从酸、碱、盐的角度进行了初步分类,其中CaCO 3、BaCl 2、Na 2SO 4、NaCl属于 。
【查阅资料】BaSO 4固体不溶于水,也不溶于稀盐酸。
【实验探究】甲同学设计了如下的实验方案。
实验步骤 |
实验现象 |
实验结论 |
a.取少量该粉末于试管中,加入足量水充分溶解 |
有白色沉淀 |
原粉末中一定含有CaCO 3 |
b.将步骤a试管中物质过滤,向滤液中滴加酚酞溶液 |
溶液变红 |
原粉末一定含有
|
乙同学认为甲同学步骤a的结论不一定正确,其理由是 (用化学方程式表示)。他补充了如下实验,取白色沉淀于试管中,加入足量稀盐酸,观察到有气泡产生且 。从而得出结论:步骤a中得到的白色沉淀全部是CaCO 3。
丙同学取甲同学步骤b中已变红的溶液,向其中逐滴滴入稀硫酸,发现有白色沉淀生成且溶液褪色。溶液褪色的原因用化学方程式表示为 。
【总结归纳】通过以上探究,原白色粉末中无法确定的成分是 (填化学式)

 粤公网安备 44130202000953号
粤公网安备 44130202000953号