2007年全国统一高考理综试卷(宁夏卷)化学部分
根据下表中烃的分子式排列规律,判断空格中烃的同分异构体数目是
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| A. |
3 |
B. |
4 |
C. |
5 |
D. |
6 |
下列除去杂质的方法正确的是()
①除去乙烷中少量的乙烯:光照条件下通入,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸氢钠溶液洗涤,分液、干燥、蒸馏;
③除去中少量的:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
| A. | ①② | B. | ②④ |
| C. | ③④ | D. | ②③ |
下列叙述错误的是
| A. | 和 属于同一种元素,它们互为同位素 |
| B. | 和 是不同的核素,它们的质子数相等 |
| C. | 和 的质量数相等,它们的中子数不等 |
| D. | 和 的电子数相等,中子数也相等 |
若表示阿伏加德罗常数,下列说法正确的是()
| A. | 作为氧化剂得到的电子数为 |
| B. | 在 ,101 kPa时,22.4 L氢气中含有 个氢原子 |
| C. | 14 g氮气中含有7 个电子 |
| D. | 个一氧化碳分子和0.5 mol甲烷的质量比为7∶4 |
下列反应的离子方程式正确的是
| A. | 锌片插入硝酸银溶液中: |
| B. | 碳酸氢钙溶液加到醋酸中: ↑ |
| C. | 少量金属钠加到冷水中: ↑ |
| D. | 氢氧化铜加到盐酸中: |
铁粉与含有的溶液完全反应后,得到铜,则参与反应的与的物质的量之比为
| A. | 1∶7 | B. | 7∶1 |
| C. | 7∶8 | D. | 8∶7 |
一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20.0,与反应前的体积相比,反应后体积缩小的百分率是()
| A. | 16.7 | B. | 20.0 |
| C. | 80.0 | D. | 83.3 |
以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、泥三角、玻璃棒、药匙、托盘天平
实验步骤:
①准确称量一个干净、干燥的坩埚;
②在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量过的试样放入研钵中研细,再放回到坩埚中;
③将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是;
(2)指出实验步骤中存在的错误并改正:;
(3)硫酸钠不能放置在空气中冷却的原因是;
(4)步骤⑤的目的是;
(5)下面的情况有可能造成测试结果偏高的是(填序号)。
| A. | 试样中含有加热不挥发的杂质 |
| B. | 试样中含有加热易挥发的杂质 |
| C. | 测试前试样已有部分脱水 |
| D. | 实验前坩埚未完全干燥 |
E.晶体加热脱水不完全
F.加热时晶体溅出
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应:;
银片上发生的电极反应:。
(2)若该电池中两电极的总质量为60,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47,试计算:
①产生氢气的体积(标准状况);②通过导线的电量。(已知=6.02×1023/,电子电荷为1.60×10-19 C)
(氮化硅()是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
++ +(1)配平上述反应的化学方程式(将化学计量数填在方框内);
+(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应中的氧化剂是,其还原产物是;
(3)该反应的平衡常数表达式为=;
(4)若知上述反应为放热反应,则其反应热Δ零(填"大于""小于"或"等于");升高温度,其平衡常数值(填"增大""减小"或"不变");
(5)若使压强增大,则上述平衡向反应方向移动(填"正"或"逆");
(6)若已知生成速率为=18·()-1,
则消耗速率为=·()-1。
工业上生产硫酸时,利用催化氧化反应将转化为是一个关键步骤。压强及温度对转化率的影响如下表(原料气各成分的体积分数为: 7%, 11%, 82%):
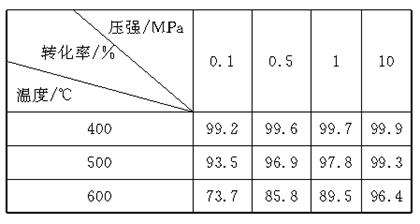
(1)已知的氧化是放热反应,如何利用表中数据推断此结论?
(2)在400~500 ℃时,的催化氧化采用常压而不是高压,主要原因是:;
(3)选择适宜的催化剂,是否可以提高的转化率?(填"是"或"否"),是否可以增大该反应所放出的热量?(填"是"或"否");
(4)为提高吸收率,实际生产中用吸收;
(5)已知:,计算每生产1万吨98%硫酸所需要的质量和由生产这些所放出的热量。
已知、、、和 5种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子。又知、和是由两种元素的原子组成。请回答:
(1)组成分子的原子的核外电子排布式是;
(2)和的分子式分别是和;分子的立体结构呈形,该分子属于分子(填"极性"或"非极性");
(3)若向的稀溶液中加入少量二氧化锰,有无色气体生成。则的分子式是,该反应的化学方程式为;
(4)若将1 mol 在氧气中完全燃烧,只生成1 mol 和2 mol ,则的分子式是。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号