福建省宁德市高一下学期期末考试化学试题
核电荷数分别为16和6的元素的原子相比较,前者的下列数据是后者的4倍的是
| A.电子数 | B.最外层电子数 | C.电子层数 | D.次外层电子数 |
下列说 法正确的是
法正确的是
| A.SiH4比CH4稳定 |
| B.O2-半径比F-的小 |
| C.Na和Cs属于第IA族元素,Cs失电子能力比Na强 |
| D.P和As属于第VA族元素,H3PO4酸性比H3AsO4弱 |
下图为周期表中短周期的一部分。已知a原子的最外层上的电子数目是次外层电子数目的一半,下列说法中不正确的是
| A.元素a的最高价氧化物的水化物的酸性比b弱 |
| B.元素a的原子半径比d的大 |
| C.元素a的单质在空气中燃烧会导致“温室效应” |
| D.元素a单质是一种良好的半导体材料 |
下列关于化学键的说法 正确的是
正确的是
| A.化学键是分子与分子之间的作用力 |
| B.形成物质中的化学键时,要吸收能量 |
| C.化学键的断裂和形成是化学反应中能量变化的主要原因 |
| D.形成或断裂同一种化学键,放出或吸收的能量是不相等的,这是化学反应中能量变化的主要原因 |
下列反应中生成物总能量高于反应物总能量的是
| A.盐酸和氢氧化钠溶液间的中和反应 | B.乙醇的燃烧 |
| C.碳酸钙受热分解 | D.铝粉与盐酸反应 |
如图所示装置,电流表G发生偏转,同时X极逐渐变粗,Y极逐渐变细,Z是电解质溶液,则X,Y,Z应是下列各组中的
| A.X是Zn,Y是Cu,Z为稀H2SO4 |
| B.X是Cu,Y是Zn,Z为稀H2SO4 |
| C.X是Fe,Y是Ag,Z为稀AgNO3溶液 |
| D.X是Ag,Y是Fe,Z为稀AgNO3溶液 |
反应4A(s)+3B(g)===2C(g)+D(g),经2min ,B的浓度减少了0.6mol/L。对此化学反应速率的正确表示是
,B的浓度减少了0.6mol/L。对此化学反应速率的正确表示是
A.用A表示的反应速率是0.4mol/(L∙min)
B.分别用B、C、D表示反应的速率,其比值是3:2:1
C.在2min末的反应速率,用B表示是0.3 mol/(L∙min)
D.在这2min内B和C 物质浓度都逐渐减少
物质浓度都逐渐减少
已知HI为无色气体,对于可逆反应H2(g) + I2(g) 2HI(g)。下列叙述能够说明反应已达平衡状态的是
2HI(g)。下列叙述能够说明反应已达平衡状态的是
| A.各物质的物质的量浓度比为1:1:2 | B.v(H2)正==v(HI)逆 |
| C.断裂2mol H-I键的同时生成1mol I-I键 | D.混合气体的颜色不再变化 |
下列关于燃料充分燃烧的说法,不正确的是
| A.通人适量的空气 | B.固体燃料燃烧前要粉碎 |
| C.液体燃料燃烧时可以以雾状喷出 | D.化石燃料在任何条件下都能充分燃烧 |
对于化学反应的限度的叙述,错误的是
| A.任何可逆反应都有一定的限度 |
| B.化学反应达到限度时,正逆反应速率相等 |
C.化学反应的限度与 时间的长短无关 时间的长短无关 |
| D.化学反应的限度是不可以改变的 |
下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述不正确的是
A.淀粉 葡萄糖 葡萄糖 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动) |
B.纤维素 葡萄糖 葡萄糖 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动) |
C.油脂 甘油和高级脂肪酸 甘油和高级脂肪酸 CO2和H2O(释放能量维持生命活动) CO2和H2O(释放能量维持生命活动) |
D.蛋白质 氨基酸 氨基酸 人体所需的蛋白质(人体生长发育) 人体所需的蛋白质(人体生长发育) |
下列物质,都能与Na反应放出H2,其产生H2速率排列顺序正确的是
①C2H5OH ②CH3COOH(溶液)③NaOH溶液
| A.①>②>③ | B.②>①>③ | C.③>①>②. | D.②>③>① |
由乙烯推测丙烯(CH3CH=CH2)与溴水反应时,对反应产物的推测正确的是
| A.CH2BrCH2CH2Br | B.CH3CHBr2CH3 |
| C.CH3CH2CHBr | D.CH3CHBrCH2Br |
下列说法正确的是
| A.乙烯的结构简式可以表示为CH2CH2 |
| B.苯、乙醇和乙酸都能发生取代反应 |
| C.高锰酸钾可以氧化苯和甲烷 |
| D.乙醇和乙酸都存在碳氧双键 |
将下列物质分别注入水中,振荡后静置,能分层浮于水面的是
①苯 ②乙酸乙酯 ③乙醇 ④乙酸 ⑤油脂 ⑥硝基苯
| A.①②③ | B.①③⑤ | C.①②⑤ | D.①②⑤⑥ |
括号内物质为杂质,下列除去杂质的做法不正确的是
| A.乙酸乙酯(乙酸和乙醇):用饱和Na2CO3溶液洗涤后分液 |
| B.乙烷(乙烯):用浓溴水洗气 |
C.乙醇(乙酸):用NaOH溶液 中和后分液 中和后分液 |
| D.乙醇(水):用生石灰吸水后蒸馏 |
控制和治理CO2是解决温室效应的有效途径。将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,以下反应中,原子利用率最高的是
A.6CO2 + 6H2O C6H12O6 +6O2 C6H12O6 +6O2 |
B.CO2 + 3H2 CH3OH +H2O CH3OH +H2O |
C.CO2 + CH4 CH3COOH CH3COOH |
D.2CO2 + 6H2 CH2==CH2 + 4H2O CH2==CH2 + 4H2O |
据报道,南极上空出现大面积的臭氧空洞。氟利昂-12对臭氧层有很强的破坏力,它的结构式为 。下列叙述正确的是
。下列叙述正确的是
| A.有两种同分异构体 | B.是平面型分子 |
| C.只有一种结构 | D.有四种同分异构体 |
下列转化不属于煤或石油的综合利用的是
| A.将煤干馏制得煤焦油和焦炭 |
| B.在一定条件下将煤与氢气转化为液体燃料 |
| C.将石油裂解制得乙烯等化工原料 |
| D.将煤变为煤饼作燃料 |
某元素原子的质量数为A ,它的离子Xn+核外有y个电子,Wg这
,它的离子Xn+核外有y个电子,Wg这 种元素的原子核内中子数为
种元素的原子核内中子数为
A. |
B. |
C.  |
D. |
下列过程中有化学键断裂的同时,又有化学键形成的是
| A.石墨转化为金刚石 | B.碘升华 | C.NaCl熔化 | D.Na2O溶于水 |
盐酸与碳酸钙固体反应时,下列措施能使最初的反应速率明显加快的是
| A.增加碳酸钙的量 | B.盐酸的用量增加一倍 |
| C.盐酸的用量减半,浓度加倍 | D.温度升高 |
下列有机反应类型的判断正确的是
| A.2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑ (取代反应) |
B.CH2=CH2 +H2O 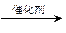 CH3CH2OH (加成反应) CH3CH2OH (加成反应) |
C.CH3COOH + CH3CH2OH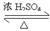 CH3COOCH2CH3+ H2O(取代反应) CH3COOCH2CH3+ H2O(取代反应) |
D. 2CH3CH2OH + O2 → 2CH3CHO + 2H2O(加成反应) 2CH3CH2OH + O2 → 2CH3CHO + 2H2O(加成反应) |
现用含氧同位素18O的乙醇C2H618O与醋酸CH3COOH作用,18O将出现在哪种物质中
| A.乙醇 | B.乙酸 | C.乙酸乙酯 | D.水 |
X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,核电荷数按照Z、X、Y、W的顺序增大。已知Z的原子次外层的电子数为2,W、X原子次外层电子数为8。
(1)请写出元素Y的原子结构示意图: ;其中元素W在周期表中的位置: 。
(2)用电子式表示X与W形成化合物的过程:  。
。
(3)X、Y、Z、W的原子半径由大到小的顺序为: 。(用元素符号表示)
(4)请写出W的单质与X的最高价氧化物对应水化物反应的化学方程式:
。
(5)元素X与元素Y相比,金属性较强的是 (用元素符号表示),请举一例实验事实证明这一结论:
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用右图的装置制备乙酸乙酯。
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作
用是: 。
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管II再测有机层的厚度,实验记录如下:
| 实验编号 |
试管Ⅰ中试剂 |
试管Ⅱ中试剂 |
测得有机层的厚度/cm |
| A |
3 mL乙醇、2 mL乙酸、1mL18mol·L-1浓硫酸 |
饱和Na2CO3溶液 |
5.0 |
| B |
3 mL乙醇、2 mL乙酸 |
0.1 |
|
| C |
3 mL乙醇、2 mL乙酸、6 mL 3mol·L-1 H2SO4 |
1.2 |
|
| D |
3 mL乙醇、2 mL乙酸、盐酸 |
1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是__________mL和__________mol·L-1。
②分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是 。
海带含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤①灼烧海带时,除需要三角架外,还需要用到的仪器是
(从下列仪器中选择所需的仪器,用标号字母填写在空白处)
| A.烧杯 | B.坩埚 | C.表面皿 | D.泥三角 E、酒精灯 F、干燥器 |
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出碘和回收苯,该步骤的实验操作名称是 。
(3)步骤⑤中,某学生选择用苯来提取碘的理由是
。
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法
。
 式。
式。 物的性质,写出其结构简式。
物的性质,写出其结构简式。 粤公网安备 44130202000953号
粤公网安备 44130202000953号