专题4:氧化还原反应
【2015北京理综化学】在通风橱中进行下列实验:
| 步骤 |
 |
 |
|
| 现象 |
Fe表面产生大量无色气泡,液面上方变为红棕色 |
Fe表面产生少量红棕色气泡后,迅速停止 |
Fe、Cu接触后,其表面产生红棕色气泡 |
下列说法中不正确的是
A.Ⅰ种气体有无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
【2015海南化学】己知在碱性溶液中可发生如下反应:
2R(OH)3+ 3C1O-+ 4OH-= 2RO4n-+3Cl-+5H2O。则RO4n-中R的化合价是
| A.+3 | B.+4 | C.+5 | D.+6 |
【2015江苏化学】下列说法正确的是
| A.分子式为C2H6O的有机化合物性质相同 |
| B.相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能 途径a:C 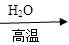 CO+H2 CO+H2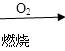 CO2+H2O CO2+H2O途径b:C  CO2 CO2 |
| C.在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数 |
| D.通过化学变化可以直接将水转变为汽油 |
【2015江苏化学】下列说法正确的是
| A.若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 |
| B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7 |
| C.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 |
D.一定条件下反应N2+3H2 2NH3达到平衡时,3v正(H2)=2v逆(NH3) 2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
【2015上海化学】下列反应中的氨与反应4NH3 + 5O2 → 4NO + 6H2O中的氨作用相同的是
| A.2Na + 2NH3 → 2NaNH2 + H2↑ | B.2NH3 + 3CuO → 3Cu + N2 +3H2O |
| C.4NH3 + 6NO → 5N2 + 6H2O | D.3SiH4 + 4NH3 → Si3N4 + 12H2 |
【2015上海化学】工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中
| A.硫元素既被氧化又被还原 |
| B.氧化剂与还原剂的物质的量之比为1:2 |
| C.每生成1molNa2S2O3,转移4mol电子 |
| D.相同条件下,每吸收10m3SO2就会放出2.5m3CO2 |
【2015上海化学】(本题共12分)氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。

完成下列填空:
(1)写出电解饱和食盐水的离子方程式 。
(2)离子交换膜的作用为: 、 。
(3)精制饱和食盐水从图中 位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“c”或“d”)
(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。
写出该反应的化学方程式 。
(5)室温下,0.1 mol/L NaClO溶液的pH 0.1 mol/L Na2SO3溶液的pH。(选填“大于”、“小于”或“等于”)。浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3–浓度从大到小的顺序为 。
已知: H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7
HClO Ki1=2.95×10-8
H2CO3 Ki1=4.3×10-7 Ki2=5.6×10-11
【2015江苏化学】烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ·mol-1
NO(g)+1/2O2(g)=NO2(g) △H=-58.2kJ·mol-1
SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ·mol-1
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_______mol·L-1。
(2)室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见下图。

①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是__________。
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是_________。
(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为8)中SO32-将NO2转化为NO2-,其离子方程式为:___________。
(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)=________[用c(SO42-)、Ksp(CaSO3)和Ksp(CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是_________。
【2015天津理综化学】FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3氧化FeCl2的离子方程式:
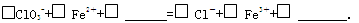
(3)FeCl3在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释
c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为 mg·L-1。

【2015浙江理综化学】Ⅰ. 请回答:
(1)H2O2的电子式___________。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由________________。
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式_____________。
(4)完成以下氧化还原反应的离子方程式:
( )MnO4-+( )C2O42-+______=( )Mn2++( )CO2↑+________
Ⅱ.化合物甲和NaAlH4都是重要的还原剂。一定条件下金属钠和H2反应生成甲。甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4。将4.80g甲加热至完全分解,得到金属钠和2.24 L(已折算成标准状况)的H2。
请推测并回答:
(1)甲的化学式__________。
(2)甲与AlCl3反应得到NaAlH4的化学方程式__________。
(3)NaAlH4与水发生氧化还原反应的化学方程式__________。
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式 。
(5)某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到固体物质即为纯净的甲;取该固体物质与水反应,若能产生H2,即可证明得到的甲一定是纯净的。判断该同学设想的制备和验纯方法的合理性并说明理由___________。
【2015新课标Ⅱ卷理综化学】(15 分)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问題:(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为 。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
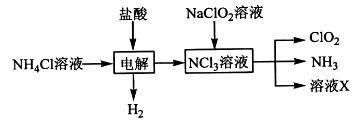
①电解时发生反应的化学方程式为 。
②溶液X中大量存在的阴离子有__________。
③除去ClO2中的NH3可选用的试剂是 (填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(3)用下图装置可以测定混合气中ClO2的含量:
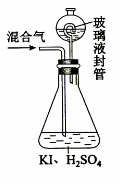
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入 3 mL 稀硫酸:
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为 。
②玻璃液封装置的作用是 。
③V中加入的指示剂通常为 ,滴定至终点的现象是 。
④测得混合气中ClO2的质量为 g。
(4)用ClO2处理过的饮用水会含有一定最的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是_______(填标号)。
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
 粤公网安备 44130202000953号
粤公网安备 44130202000953号