高考原创化学预测卷 06(山东卷)
4月25日,尼泊尔发生8.1级地震,受灾地区震后急需从外地补充大量物资。下列物质是救灾物资的一部分,相关说法不正确的是
| A.葡萄糖氯化钠注射液——用于补充热能和体液 |
| B.二氧氯(ClO2)或漂白粉——利用其氧化性对居所和饮用水消毒 |
| C.络合碘——碘化钾的水溶液,可以用于皮肤和粘膜的消毒 |
| D.电池——通常选用干电池,用于小功率电器的供电 |
下列化学用语表达正确的是
A.对硝基甲苯的结构简式: |
| B.16O2与18O2互称同位素 |
| C.果糖的实验式:CH2O |
D.CH2F2的电子式: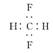 |
下列离子方程式正确的是
| A.FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-===Fe(SCN)3↓ |
B.苯酚钠溶液中通入少量CO2: |
| C.NaHCO3溶液中加过量Ca(OH)2溶液: Ca2++2HCO3-+2OH-===CaCO3↓+H2O+CO32- |
| D.BaCO3固体中加入足量稀H2SO4:BaCO3+2H+===Ba2++CO2↑+H2O |
设NA为阿伏加德罗常数的值。下列叙述不正确的是
| A.用丙烷和水蒸气高温下反应制取氢气,每产生0.3molCO,同时产生0.7NA个H2分子 |
| B.常温常压下,16 g O3所含的电子数为8NA |
| C.标准状况下 11.2 L NO与11.2 L O2混合,充分反应后所含分子数小于0.75NA |
| D.1 mol/L的Ca(ClO)2溶液中含ClO—数目一定小于2NA |
常温下,25.00 mL 浓度为0.100 0 mol·L-1 Na2CO3溶液用0.100 0 mol·L-1盐酸滴定,其滴定曲线如图所示,对滴定过程中所得溶液的说法正确的是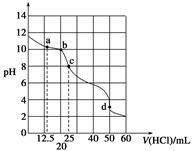
| A.a点溶液存在:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-) |
| B.b点溶液存在:5c(Cl-) =4c(HCO3-)+4c(CO32-) |
| C.c点溶液存在:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D.d点溶液溶质是NaCl和CO2,且:c(H+)= c(CO32-)+c(HCO3-)+c(OH-) |
有五种短周期主族元素X、Y、Z、W、Q,其中Q的单质是密度最小的气体,X原子的最外层电子数是内层电子数的2倍,Y和W同主族且原子序数之比为2:1,Z是短周期中原子半径最大的元素。下列叙述错误的是
| A.XQ2W分子在常温下呈气态,分子中的四个原子在同一平面内 |
| B.Z和W形成的两种离子化合物中阴、阳离子个数比均为2:1 |
| C.X、W两元素分别和Q元素化合,可形成电子数相同的两种化合物 |
| D.相应的离子半径大小关系为:Y>W>Z |
2013年三月,欧盟决定暂停征收航空碳排放税,由此可以看出人类发展与环境保护的冲突仍然尖锐,大气保护工作只能在人们的各种冲突中曲折前行。
(1)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
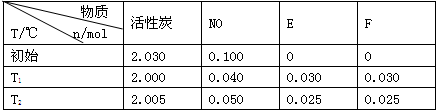
上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。
①计算K1= 。
②T2℃达到平衡后,增大压强至气体体积为1L。新平衡体系中NO的平衡浓度c(NO)= 。
(2)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
①CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
已知:②2H2O (g) ="=" 2H2 (g) + O2 (g) ΔH=+484 kJ/mol,
写出CO完全燃烧生成CO2的热化学方程式: 。
(3)现以CO、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备高铁酸盐Na2FeO4的装置如图所示。其中Y为CO2。
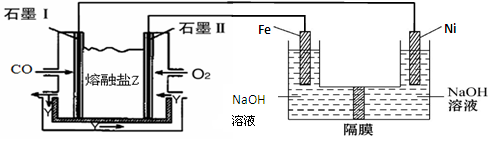
写出石墨I电极上发生反应的电极反应式 。
写出电解池中生成FeO42-的电极反应式为 。
(4)高铁酸钾是一种新型水处理剂,它既有杀菌消毒的功能,又有净水的功能,请根据所需知识简要解释其净水的原理: 。
Ⅰ.硝基苯甲酸乙酯在OH — 存在下发生水解反应:
O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH
O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050mol/L ,15℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示,回答下列问题:
| t/s |
0 |
120 |
180 |
240 |
330 |
530 |
600 |
700 |
800 |
| a/% |
0 |
33.0 |
41.8 |
48.8 |
58.0 |
69.0 |
70.4 |
71.0 |
71.0 |
(1)计算该反应在180~240s区间的平均反应速率 。
(2)为了提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可以采取的措施有: (要求写出两条)。
Ⅱ.某研究性学习小组利用下图所示装置进行实验。将CN-的浓度为0.2000 mol·L-1的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②锥形瓶中充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。
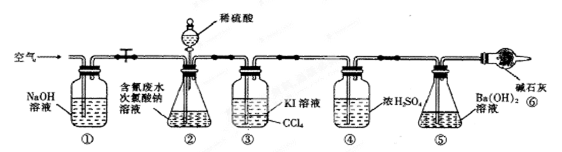
已知装置②中发生的主要反应依次为:
CN-+ClO-=CNO-+Cl-
2CNO-+2H++3C1O-=N2↑+2CO2↑+3C1-+H2O
(3)①和⑥中所装碱性物质的作用是 。
(4)装置③除去的物质是 ,一段时间后,CCl4层的颜色为 。装置②中,生成该物质的离子方程式为 。
(5)反应结束后,缓缓通入空气的目的是 。
(6)为计算该实验中含氰废水被处理的百分率,实验结束后要测定装置⑤的生成沉淀质量,经过滤、洗涤、反复烘干称量至恒重后测得沉淀质量为3.55g,则废水中CN-的转化率为 (保留三位有效数字)。
铬是极硬的银白色金属,主要用于冶炼各种合金钢和电镀。已知铬在自然界最重要的矿物是铬铁矿[Fe(CrO2)2或FeO·Cr2O3],工业上制备较纯的金属铬的方法常用铝热法,其中一种简要流程如下:

(1)完成焙烧时的化学方程式并配平:
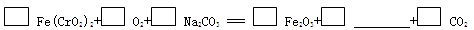
(2)如果在实验室模拟操作①,应包括过滤和洗涤。实验室洗涤沉淀的操作是: 。
(3)操作③中发生反应的化学方程式为: 。
(4)重铬酸钾为橙红色晶体,广泛用于鞣革、电镀、有机合成等领域。鞣革过程中,生皮中的蛋白质发生了 而变得经久耐用。工业可用电解法来处理含Cr2O72-废水,实验室利用下图装置模拟该法。电解过程中溶液里发生反应:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
若某一时间段内溶液中减少了0.01mol Cr2O72-,则这段时间 电路中至少转移了_____mol电子。
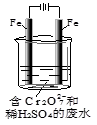
(5)已知:①25℃时,Na2CrO4溶液中仅存在两种含铬离子(CrO42-、Cr2O72-),在溶液中CrO42-呈黄色,Cr2O72-呈橙色,且二者可以相互转变:2CrO42-+2H+ Cr2O72-+H2O K= 5×1014
Cr2O72-+H2O K= 5×1014
②25℃时,BaCr2O7易溶于水,BaCrO4难溶于水,且Ksp(BaCrO4)=1×10-10若将0.2mol/L的Na2CrO4溶液和一定浓度的硝酸等体积混合,充分混合后溶液的pH=2,则此时溶液中两种含铬离子的浓度之比c(Cr2O72-)/c(CrO42-)≈ ;取此混合液1mL与1mL 2mol/L的BaCl2溶液混合,试判断混合溶液 (填“能”或“不能”)生成沉淀
【化学——化学与技术】钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如下:
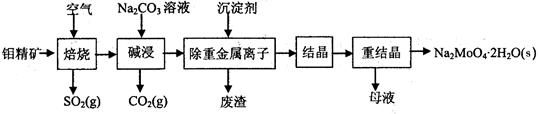
(1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是: 。
(2)写出焙烧时生成MoO3的化学方程式为: 。
(3)写出“碱浸”反应的离子方程式: 。
(4)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-。当BaMoO4开始沉淀时,则SO42-的去除率= 。已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.040mol·L-1,Ksp(BaSO4)= 1.0×10-10、Ksp(BaMoO4)= 4.0×10=8,加入Ba(OH)2固体引起的溶液体积变化可忽略。
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果:
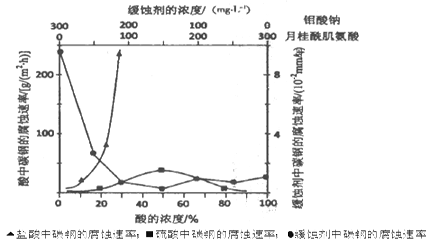
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是 。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4~Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2,则NaNO2的作用是 。
【化学——物质结构与性质】太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)镓的基态原子的电子排布式是 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)。
(3)H2Se的酸性比H2S________(填“强”或“弱”)。气态SeO3分子的立体构型为________。
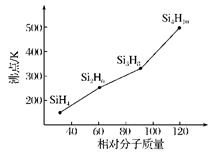
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是_________。
(5)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往 具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,则[B(OH)4]-中B的原子杂化类型为 ;
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是 ,反应的离子方程式为 ;
(7)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为_____________,若该晶胞的边长为a pm,则合金的密度为______________________g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
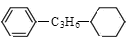 模式的侧链的二元同分异构体数目为:
模式的侧链的二元同分异构体数目为: ;②C物质苯环上一卤代物只有两种。
;②C物质苯环上一卤代物只有两种。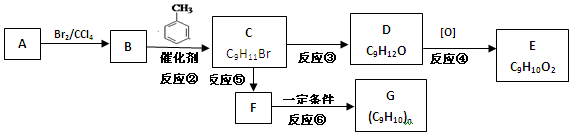
 粤公网安备 44130202000953号
粤公网安备 44130202000953号