铬是极硬的银白色金属,主要用于冶炼各种合金钢和电镀。已知铬在自然界最重要的矿物是铬铁矿[Fe(CrO2)2或FeO·Cr2O3],工业上制备较纯的金属铬的方法常用铝热法,其中一种简要流程如下:

(1)完成焙烧时的化学方程式并配平:

(2)如果在实验室模拟操作①,应包括过滤和洗涤。实验室洗涤沉淀的操作是: 。
(3)操作③中发生反应的化学方程式为: 。
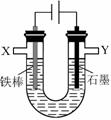
(4)重铬酸钾为橙红色晶体,广泛用于鞣革、电镀、有机合成等领域。鞣革过程中,生皮中的蛋白质发生了 而变得经久耐用。工业可用电解法来处理含Cr2O72-废水,实验室利用下图装置模拟该法。电解过程中溶液里发生反应:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
若某一时间段内溶液中减少了0.01mol Cr2O72-,则这段时间 电路中至少转移了_____mol电子。

(5)已知:①25℃时,Na2CrO4溶液中仅存在两种含铬离子(CrO42-、Cr2O72-),在溶液中CrO42-呈黄色,Cr2O72-呈橙色,且二者可以相互转变:2CrO42-+2H+ Cr2O72-+H2O K= 5×1014
Cr2O72-+H2O K= 5×1014
②25℃时,BaCr2O7易溶于水,BaCrO4难溶于水,且Ksp(BaCrO4)=1×10-10若将0.2mol/L的Na2CrO4溶液和一定浓度的硝酸等体积混合,充分混合后溶液的pH=2,则此时溶液中两种含铬离子的浓度之比c(Cr2O72-)/c(CrO42-)≈ ;取此混合液1mL与1mL 2mol/L的BaCl2溶液混合,试判断混合溶液 (填“能”或“不能”)生成沉淀

 K2SO4 + MnSO4 + Fe2(SO4)3 + H2O
K2SO4 + MnSO4 + Fe2(SO4)3 + H2O
 粤公网安备 44130202000953号
粤公网安备 44130202000953号