二氧化氯( )是一种常用的消毒剂,工业以粗盐水(含少量 、 、 ﹣等杂质离子)为原料生产 ,工艺流程如图所示。
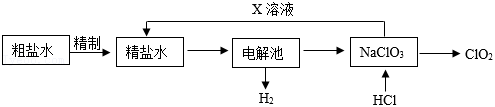
(1)除去粗盐中的难溶性杂质的步骤是溶解、 。
(2)“精制”中,用下列药品除去杂质离子,请写出一组合理的添加顺序 (填序号)。
①
②
③
(3)“精制”最后应加入适量盐酸,其目的是除去溶液中的 (填离子符号)。
(4)电解池中发生的主要化学反应方程式为 。
(5)生产过程中能循环利用的物质X是 (填化学式)。
二氧化氯( )是一种常用的消毒剂,工业以粗盐水(含少量 、 、 ﹣等杂质离子)为原料生产 ,工艺流程如图所示。

(1)除去粗盐中的难溶性杂质的步骤是溶解、 。
(2)“精制”中,用下列药品除去杂质离子,请写出一组合理的添加顺序 (填序号)。
①
②
③
(3)“精制”最后应加入适量盐酸,其目的是除去溶液中的 (填离子符号)。
(4)电解池中发生的主要化学反应方程式为 。
(5)生产过程中能循环利用的物质X是 (填化学式)。