工业上利用氟碳铈矿(主要成分为CeFCO3)提取CeCl3的一种工艺流程如图:
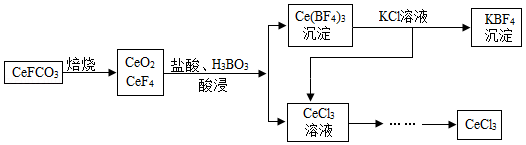
(1)流程中Ce(BF4)3转化成KBF4的基本反应类型是 。
(2)在足量氧气中高温焙烧CeFCO3,化学方程式为 。
(3)流程涉及的化合物中,铈元素的化合价为 价。
(4)酸浸过程中,CeO2与盐酸反应有刺激性气味的气体单质生成,且化学方程式中CeO2与盐酸的化学计量数之比为1:4,则化学方程式为 。
工业上利用氟碳铈矿(主要成分为CeFCO3)提取CeCl3的一种工艺流程如图:

(1)流程中Ce(BF4)3转化成KBF4的基本反应类型是 。
(2)在足量氧气中高温焙烧CeFCO3,化学方程式为 。
(3)流程涉及的化合物中,铈元素的化合价为 价。
(4)酸浸过程中,CeO2与盐酸反应有刺激性气味的气体单质生成,且化学方程式中CeO2与盐酸的化学计量数之比为1:4,则化学方程式为 。