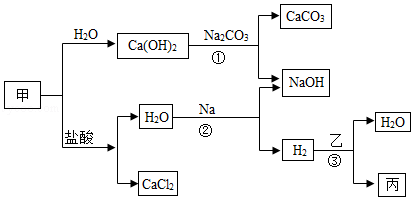
甲、乙、丙是初中化学常见物质.这些物质之间的转化关系如下图所示.
根据以上信息,请回答下列问题.
(1)写出甲的化学式 .
(2)写出反应①的化学方程式 .
(3)写出反应②的化学方程式 .该反应属于 反应(填基本反应类型).
(4)反应③在一定温度下进行,若乙为Fe2O3,则丙为Fe;若丙为Cu,则乙为 (填化学式).
(5)请完成下列表格,证明Fe的金属活动性比Cu的强.
实验方案 |
实验现象 |
将铁片浸入 (填化学式)溶液中 |
铁片表面析出 固体 |
甲、乙、丙是初中化学常见物质.这些物质之间的转化关系如下图所示.

根据以上信息,请回答下列问题.
(1)写出甲的化学式 .
(2)写出反应①的化学方程式 .
(3)写出反应②的化学方程式 .该反应属于 反应(填基本反应类型).
(4)反应③在一定温度下进行,若乙为Fe2O3,则丙为Fe;若丙为Cu,则乙为 (填化学式).
(5)请完成下列表格,证明Fe的金属活动性比Cu的强.
实验方案 |
实验现象 |
将铁片浸入 (填化学式)溶液中 |
铁片表面析出 固体 |