20℃时,根据某固体物质在不同质量的水中达到饱和状态时所溶解的质量,绘制成如图所示的斜线,回答下列问题:
(1)20℃时,该固体物质的溶解度为 。
(2)C点所对应的溶液是 (填“饱和溶液”或“不饱和溶液”)。
(3)若从D点溶液得到A点溶液,需增加该溶质 g。
(4)图中四点所对应的溶液质量分数大小关系为 。
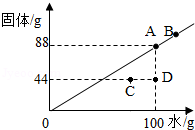
20℃时,根据某固体物质在不同质量的水中达到饱和状态时所溶解的质量,绘制成如图所示的斜线,回答下列问题:
(1)20℃时,该固体物质的溶解度为 。
(2)C点所对应的溶液是 (填“饱和溶液”或“不饱和溶液”)。
(3)若从D点溶液得到A点溶液,需增加该溶质 g。
(4)图中四点所对应的溶液质量分数大小关系为 。
