如图是A、B、C三种固体物质的溶解度曲线,请回答下列问题:
(1)B物质中含有少量的A物质,提纯B的方法是 (填“冷却结晶法”或“蒸发溶剂结晶法”)
(2)t3℃时,50g的A物质加入到50g水中充分溶解,最终形成溶液的质量为 g.
(3)t3℃时,将A、B、C三种物质的饱和溶液降温到t1℃,所得溶液中溶质质量分数由小到大的顺序为 .
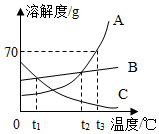
如图是A、B、C三种固体物质的溶解度曲线,请回答下列问题:
(1)B物质中含有少量的A物质,提纯B的方法是 (填“冷却结晶法”或“蒸发溶剂结晶法”)
(2)t3℃时,50g的A物质加入到50g水中充分溶解,最终形成溶液的质量为 g.
(3)t3℃时,将A、B、C三种物质的饱和溶液降温到t1℃,所得溶液中溶质质量分数由小到大的顺序为 .
