取MgCl 2和NaCl的固体混合物10g做如下实验.请根据图中实验及数据进行计算.
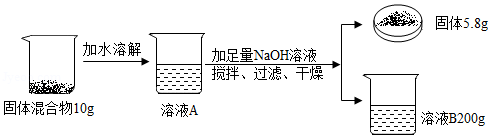
(1)MgCl 2中镁元素和氯元素的质量比为 .
(2)计算溶液B中NaCl的质量分数(写出计算过程).
(3)要配制与溶液B相同质量分数的NaCl溶液200g,需要质量分数为24.4%的NaCl溶液的质量是多少?(写出计算过程)
取MgCl 2和NaCl的固体混合物10g做如下实验.请根据图中实验及数据进行计算.

(1)MgCl 2中镁元素和氯元素的质量比为 .
(2)计算溶液B中NaCl的质量分数(写出计算过程).
(3)要配制与溶液B相同质量分数的NaCl溶液200g,需要质量分数为24.4%的NaCl溶液的质量是多少?(写出计算过程)