请结合如图所示实验回答问题:
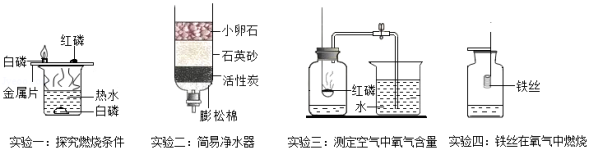
(1)实验一中金属片上的白磷燃烧而热水中的白磷不燃烧,说明燃烧的条件之一是 ;
(2)实验二中活性炭具有 性,因而可除去水中的色素和异味。
(3)实验三中若测得空气中O2含量小于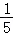 ,可能的原因是 ;(答一点即可)。
,可能的原因是 ;(答一点即可)。
(4)实验四中集气瓶里水的作用是 。
请结合如图所示实验回答问题:

(1)实验一中金属片上的白磷燃烧而热水中的白磷不燃烧,说明燃烧的条件之一是 ;
(2)实验二中活性炭具有 性,因而可除去水中的色素和异味。
(3)实验三中若测得空气中O2含量小于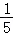 ,可能的原因是 ;(答一点即可)。
,可能的原因是 ;(答一点即可)。
(4)实验四中集气瓶里水的作用是 。