工业上将纯净干燥的氯气通入到0.5 mol·L-1 NaOH溶液中得到漂白水。

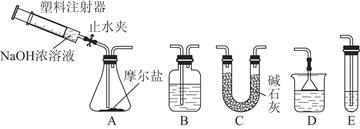
某同学想在实验室探究Cl2性质并模拟制备漂白水,上图是部分实验装置。已知KMnO4与浓盐酸反应可以制取Cl2。(注:装置D中布条为红色)
(1)配平KMnO4与盐酸反应的化学方程式:
KMnO4+ HCl(浓) = KCl + MnCl2+ Cl2↑+ H2O
(2)如果反应中转移0.5mol电子,则生成Cl2的物质的量为_______________。
(3)浓硫酸的作用是 。
(4)实验时装置D中的现象是 。
(5)装置E中发生化学反应的离子方程式为 。
(6)配制500 mL物质的量浓度为0.5 mol·L-1 NaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和 ,需称量的NaOH的质量是 。

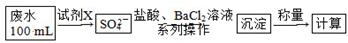
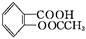 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: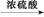

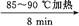
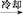
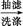 粗产品
粗产品
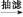
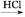
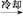
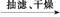 乙酰水杨酸
乙酰水杨酸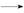 测熔点
测熔点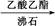
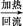
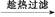
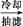
 乙酰水杨酸
乙酰水杨酸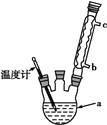

 粤公网安备 44130202000953号
粤公网安备 44130202000953号