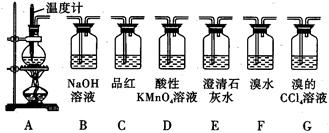
某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图。

已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大,I2(S) + I- I3-(aq)。
I3-(aq)。
容器中盛放的试剂分别为:
A.MnO2
C.0.5000 mol/L的KI溶液
D.AgNO3溶液
E.NaOH溶液
F.浓盐酸
完成下列填空:
(1)仪器A的名称 ,B中的试剂是_________________。
(2)当D装置中出现 时,停止加热;E的作用是_______________。
(3)当氯气开始进入C时,C中看到的现象是____________________;不断向C中通入氯气,看到溶液颜色逐渐加深,后来出现深褐色沉淀,试运用平衡移动原理分析产生这些现象的原因___________________。
(4)持续不断地向C中通入氯气,看到C中液体逐渐澄清,最终呈无色。推测此时C中无色溶液里含碘物质的化学式_________________(此时溶液中只有一种含碘微粒)。
为确定含碘物质中碘元素的化合价,进行如下实验:
① 取反应后C中溶液5.00mL(均匀)于锥形瓶中,加入KI(过量)和足量稀硫酸。
②向上述锥形瓶中滴加淀粉指示剂,溶液变蓝,用0.6250 mol/L的Na2S2O3溶液滴定至蓝色刚好褪去,耗Na2S2O3溶液24.00 mL。
已知: I2 + 2 S2O32-→ 2 I-+ S4O62-
计算:碘元素的化合价为_______________。
(5)欲检验某溶液中是否含有I-,可使用的试剂为氯水和淀粉溶液。合理的实验操作为_________________________________。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号