有机化学反应因条件不同,可生成不同的产物。例如:
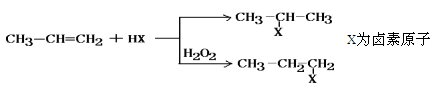
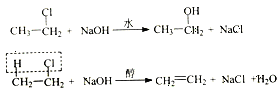
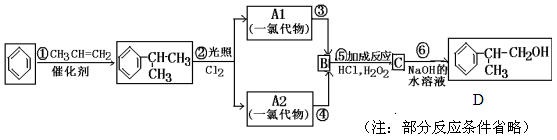
请回答下列问题:
(1)反应①的反应类型: ________________;
(2)写出A2的结构简式:_________________;
(3)反应⑤的化学方程式:___________________;
(4)满足下列条件的D的同分异构体有_________种。
①含有苯环 ②有2个甲基 ③有羟基(-OH)
有机化学反应因条件不同,可生成不同的产物。例如:
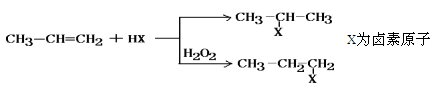
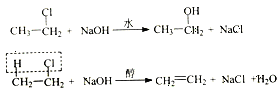

请回答下列问题:
(1)反应①的反应类型: ________________;
(2)写出A2的结构简式:_________________;
(3)反应⑤的化学方程式:___________________;
(4)满足下列条件的D的同分异构体有_________种。
①含有苯环 ②有2个甲基 ③有羟基(-OH)