在密闭容器中进行反应N2O4(g) 2NO2(g) ΔH=57 kJ· mol-1,在温度为T1、T2时,平衡体系中NO2的物质的量分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) ΔH=57 kJ· mol-1,在温度为T1、T2时,平衡体系中NO2的物质的量分数随压强变化曲线如图所示。下列说法正确的是( )
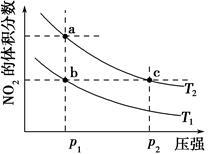
| A.a、c两点的反应速率:a>c |
| B.a、c两点气体的颜色:a深,c浅 |
| C.b、c两点的转化率:b>c |
| D.由b点到a点,可以用加热的方法 |
在密闭容器中进行反应N2O4(g) 2NO2(g) ΔH=57 kJ· mol-1,在温度为T1、T2时,平衡体系中NO2的物质的量分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) ΔH=57 kJ· mol-1,在温度为T1、T2时,平衡体系中NO2的物质的量分数随压强变化曲线如图所示。下列说法正确的是( )

| A.a、c两点的反应速率:a>c |
| B.a、c两点气体的颜色:a深,c浅 |
| C.b、c两点的转化率:b>c |
| D.由b点到a点,可以用加热的方法 |