利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:SO2(g)+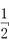 O2(g)
O2(g) SO3(g) ΔH=-98 kJ· mol-1。
SO3(g) ΔH=-98 kJ· mol-1。
(1)某温度下该反应的平衡常数K= ,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)________v(逆)(填“<”“>”或“=”)。
,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正)________v(逆)(填“<”“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后容器体积变为1.6 L,则SO2的平衡转化率为________。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
(4)二氧化硫的催化氧化原理为2SO2(g)+O2(g) 2SO3(g) ,反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示。
2SO3(g) ,反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示。

下列说法错误的是________
A.在D点时v正<v逆
B.反应2SO2(g)+O2(g) 2SO3(g) ΔH<0
2SO3(g) ΔH<0
C.若B、C点的平衡常数分别为KB、KC,则KB>KC
D.恒温恒压下向平衡体系中通入氦气,平衡向左移动


 粤公网安备 44130202000953号
粤公网安备 44130202000953号