天然气、氨在工农业生产中具有重要意义。
(1)25 ℃、l0l kPa时,32 g CH4完全燃烧生成稳定的氧化物时放出1780.6 kJ的热量,写出该反应的热化学方程式________________________________。
(2)合成氨用的氢气,工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g) CO(g)+3H2(g),已知有关反应的能量变化如下图:
CO(g)+3H2(g),已知有关反应的能量变化如下图: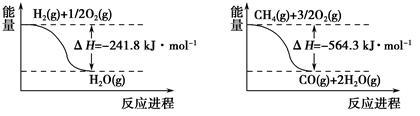
则该反应的焓变ΔH=______________________________________。
天然气、氨在工农业生产中具有重要意义。
(1)25 ℃、l0l kPa时,32 g CH4完全燃烧生成稳定的氧化物时放出1780.6 kJ的热量,写出该反应的热化学方程式________________________________。
(2)合成氨用的氢气,工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g) CO(g)+3H2(g),已知有关反应的能量变化如下图:
CO(g)+3H2(g),已知有关反应的能量变化如下图:
则该反应的焓变ΔH=______________________________________。