碳酸锂广泛应用于陶瓷和医药等领域,以β—锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原料制备Li2CO3的工艺流程如下:
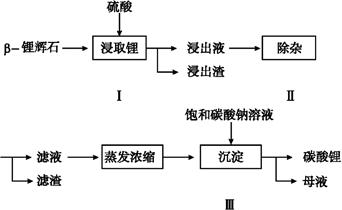
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303 K下的溶解度分别为34.2 g、12.7 g和1.3 g。
(1)步骤Ⅰ前,β—锂辉石要粉碎成细颗粒的目的是 。
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-;另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入 (填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有 。
(4)步骤Ⅲ中,生成沉淀的离子方程式为 。
(5)从母液中可回收的主要物质是 。