某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验:
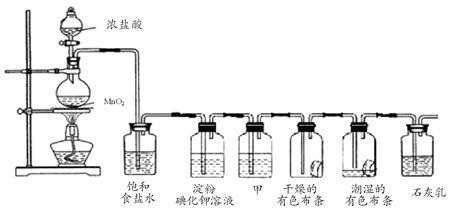
请按要求回答下列问题:
(1)淀粉碘化钾溶液中观察到的现象是 ,反应的离子方程式为 。
(2)若干燥的有色布条不褪色,潮湿的有色布条褪色,则甲中盛放 (填名称)。
(3)C12与石灰乳反应制取漂白粉的化学方程式为 。
(4)该兴趣小组用8.7g MnO2与足量的浓盐酸制备氯气,则理论上最多可制得标准状况下的Cl2 L。
 cZ(g)。下图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强关系示意图。
cZ(g)。下图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强关系示意图。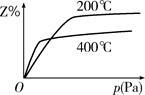

 3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。 粤公网安备 44130202000953号
粤公网安备 44130202000953号