利用物质之间的性质差异可提纯物质。
(1)除去Fe2O3中的Al2O3,反应的离子方程式是__________。
(2)除去FeCl3溶液中的CuCl2,选用的试剂是__________。
(3)除去粗盐水中Ca2+、Mg2+、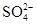 等杂质,选用的试剂是①盐酸 ②BaCl2 ③NaOH ④Na2CO3
等杂质,选用的试剂是①盐酸 ②BaCl2 ③NaOH ④Na2CO3
i.上述4种试剂的加入顺序是__________。
ii.加入盐酸的作用是(用离子方程式表示)__________。
利用物质之间的性质差异可提纯物质。
(1)除去Fe2O3中的Al2O3,反应的离子方程式是__________。
(2)除去FeCl3溶液中的CuCl2,选用的试剂是__________。
(3)除去粗盐水中Ca2+、Mg2+、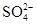 等杂质,选用的试剂是①盐酸 ②BaCl2 ③NaOH ④Na2CO3
等杂质,选用的试剂是①盐酸 ②BaCl2 ③NaOH ④Na2CO3
i.上述4种试剂的加入顺序是__________。
ii.加入盐酸的作用是(用离子方程式表示)__________。