(1)25℃时,某NaCl溶液中c(Cl–)=1×10-4 mol·L–1,则该溶液中c(Na+)∶c(OH-)=
(2)25℃时,将0.1 mol·L–1NaOH溶液与0.06 mol·L–1的H2SO4溶液等体积混合(忽略混合后体积的变化),求所得溶液的pH=。25℃时,pH值为8的NaOH溶液与pH值为10的NaOH溶液等体积混合后,溶液中氢离子浓度最接近。
(3)25℃时,下列四种溶液中,①pH=0的盐酸②0.1 mol·L–1的盐酸③0.01 mol·L–1的NaOH溶液④pH=11的NaOH溶液,由水电离生成氢离子浓度之比①︰②︰③︰④是:(填字母)
| A.1︰10︰100︰1000 |
B.0︰1︰12︰11 |
| C.14︰13︰12︰11 |
D.14︰13︰2︰3 |
(4)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11,
①则该温度下水的Kw= 。
②在该温度下测得某溶液pH=3,则该溶液中c(H+)∶c(OH-)=________。
③该温度下将pH=2的盐酸和pH=11的氢氧化钠溶液等体积混合,pH=______________
(5) 纯水中c(H+)=5.0×10–7 mol·L–1,则此时纯水中的c(OH–) =;若温度不变,滴入稀硫酸使c(H+)=5.0×10–3 mol·L–1,则c(OH–) =;在该温度时,往水中滴入NaOH溶液,溶液中的c(OH–)=5.0×10–2 mol·L–1,则溶液中c(H+)=。
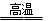 Si + 2CO↑。该反应中,还原剂是 (填化学式),被还原的物质是 (填化学式);若反应中消耗了2 mol C,则生成 _____mol Si,转移电子的物质的量为 mol。
Si + 2CO↑。该反应中,还原剂是 (填化学式),被还原的物质是 (填化学式);若反应中消耗了2 mol C,则生成 _____mol Si,转移电子的物质的量为 mol。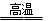 Si + 2CO↑。该反应中,还原剂是 (填化学式),被还原的物质是 (填化学式);若反应中消耗了2 mol C,则生成 _____mol Si,转移电子的物质的量为 mol。
Si + 2CO↑。该反应中,还原剂是 (填化学式),被还原的物质是 (填化学式);若反应中消耗了2 mol C,则生成 _____mol Si,转移电子的物质的量为 mol。