利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应。常用来生产液氨和氨水。
完成下列填空:
(1)右图表示合成氨时生成1mol生成物时的能量变化,E的单位为kJ。请写出合成氨的热化学方程式 (热量用E1、E2或E3表示)。
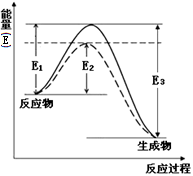
该图中的实线与虚线部分是什么反应条件发生了变化? 。
(2)在一定温度下,若将4amol H2和2amol N2放入VL的定容密闭容器中,2分钟后测得N2的转化率为50%,则该段时间用H2表示的反应速率为 摩尔/(升–秒)。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是 (填“正向移动”“逆向移动”或“不移动”)。
(3)液氨和水类似,也能电离:2NH3 NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K 2×10-30(填“<”、“>”或“=”);
NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K 2×10-30(填“<”、“>”或“=”);
②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒物质的量大小排列为:
(4)工厂生产的氨水作肥料时需要稀释。用水稀释0.1mol/L稀氨水时,溶液中随着水量的增加而减少的是 。
a.c(NH4+)/c(NH3•H2O) b.c(NH3•H2O)/c(OH-)
c.c(OH-)/c(H+) d.c(H+)/c(NH4+)

 粤公网安备 44130202000953号
粤公网安备 44130202000953号