某不锈钢(主要成分为Fe)样品中含有铝、铜等(其它成分忽略),为了测定该合金中铁的含量,有人设计如下工艺流程:
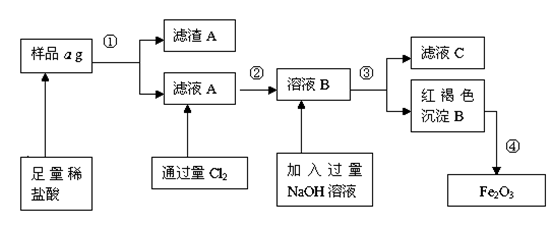
(1)滤液C中溶质含有_ _(写化学式);
(2)反应②的离子方程式为: ,如何验证滤液A中含Fe2+,而不含Fe3+____ _____。
(3)对所得Fe2O3固体称量得质量为b g,计算该样品中铁元素质量分数的表达式为(用含a、b的式子表示)___ __。
某不锈钢(主要成分为Fe)样品中含有铝、铜等(其它成分忽略),为了测定该合金中铁的含量,有人设计如下工艺流程:

(1)滤液C中溶质含有_ _(写化学式);
(2)反应②的离子方程式为: ,如何验证滤液A中含Fe2+,而不含Fe3+____ _____。
(3)对所得Fe2O3固体称量得质量为b g,计算该样品中铁元素质量分数的表达式为(用含a、b的式子表示)___ __。