W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。

Ⅰ.(1)X位于元素周期表中的位置______________;W的基态原子核外有_________个未成对电子。
(2)X的单质和Y的单质相比,熔点较高的是__________(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是___________(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是 ____________。
Ⅱ.部分化学键的键能见下表:
| 化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
| 键能/ kJ•mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
(1)比较下列两组物质的熔点高低(填“”“”)SiC________Si;SiCl4________SiO2
(2)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g),
Si(s)+4HCl(g),
计算该反应的反应热△H=_________kJ·mol-1。
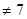 ,则HR的电离方程式为。
,则HR的电离方程式为。
 (3)①一种含Cr的催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子的电子排布式为。
(3)①一种含Cr的催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子的电子排布式为。 CH3COOC2H5(l)+H2O(l)ΔH=-8.62kJ·mol-1
CH3COOC2H5(l)+H2O(l)ΔH=-8.62kJ·mol-1
 CO2(g)+H2(g)
CO2(g)+H2(g)
 H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是。
H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是。 浓度由大到小的顺序是(填序号)。
浓度由大到小的顺序是(填序号)。 粤公网安备 44130202000953号
粤公网安备 44130202000953号