氰(CN)2,硫氰(SCN)2等称为拟卤素,与卤素单质性质相似,它们的阴离子与也卤素阴离子性质相似,阴离子的还原性顺序为: Cl-<Br-<CN-<SCN-<I-,又知,拟卤素形成的无氧酸和含氧酸一般为弱酸,下列反应中,不合理的是
A.4HCN(浓)+MnO2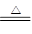 Mn(CN)2+(CN)2↑+2H2O Mn(CN)2+(CN)2↑+2H2O |
| B.(CN)2+H2O=2H++CN-+CNO- |
| C.(CN)2+2OH-=CN-+CNO-+H2O |
| D.(CN)2+2SCN-=2CN-+(SCN)2 |
氰(CN)2,硫氰(SCN)2等称为拟卤素,与卤素单质性质相似,它们的阴离子与也卤素阴离子性质相似,阴离子的还原性顺序为: Cl-<Br-<CN-<SCN-<I-,又知,拟卤素形成的无氧酸和含氧酸一般为弱酸,下列反应中,不合理的是
A.4HCN(浓)+MnO2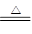 Mn(CN)2+(CN)2↑+2H2O Mn(CN)2+(CN)2↑+2H2O |
| B.(CN)2+H2O=2H++CN-+CNO- |
| C.(CN)2+2OH-=CN-+CNO-+H2O |
| D.(CN)2+2SCN-=2CN-+(SCN)2 |