空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题。

工业制硫酸的过程中,SO2催化氧化的原理为:2SO2(g)+O2(g)  2SO3(g) + Q
2SO3(g) + Q
某温度下,测得SO2(g)的平衡转化率( )与体系总压强( p )的关系如上图所示。
)与体系总压强( p )的关系如上图所示。
28.a、b两点对应的平衡常数K(a) K(b) (填“>”、 “<”或“=”,下同),SO3浓度c(a) c(b)。c点时,反应速率υ(正) υ(逆)。
将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
||
| SO2 |
O2 |
SO2 |
O2 |
||
| 1 |
T1 |
4 |
2 |
x |
0.8 |
| 2 |
T2 |
4 |
2 |
0.4 |
y |
29.实验1从开始到反应达到化学平衡时,用去时间t 分钟,则υ(SO2)表示的反应速率为 ,温度T1大于T2的理由是 。
30.制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐。
①0.1 mol/L的NaHSO3溶液中c(H+) >c(OH-),用水解和电离理论的角度解释其原因 ,若往溶液中加入氨水至中性,则c(Na+) c(HSO3-)+c(SO32-)+c(H2SO3)(填“>”、 “﹤”或 “=”)。
②往0.1 mol/L 的Na2SO3溶液加入少量NaOH固体,完全溶解后溶液中c(Na+) :c(SO32-)的比值 (填“变大”、“变小”或“保持不变”)。
 N2+2CO2,则该反应的化学平衡常数表达式K=________。
N2+2CO2,则该反应的化学平衡常数表达式K=________。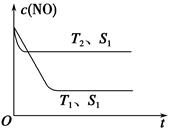
 2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是________。
2N2(g)+3H2O(g) ΔH<0。在恒容的密闭容器中,下列有关说法正确的是________。 CH3OH(g) ΔH1=-90.7 kJ·mol-1 ①
CH3OH(g) ΔH1=-90.7 kJ·mol-1 ①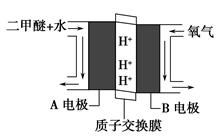
 Si(s)+3HCl(g)。
Si(s)+3HCl(g)。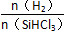 时,反应物X的平衡转化率关系如图所示。
时,反应物X的平衡转化率关系如图所示。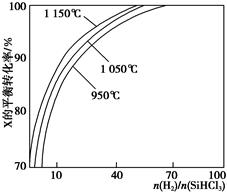
 粤公网安备 44130202000953号
粤公网安备 44130202000953号