Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定存在。
Ⅰ.制备Na2S2O3·5H2O的反应原理:Na2SO3+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80mL蒸馏水,另取5g研细的硫粉,用3mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图,部分加持装置略去),水浴加热,微沸60分钟。
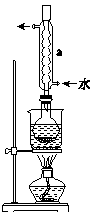
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤,干燥,得到产品。
回答下列问题:
(1)硫粉在反应前用乙醇润湿的目的是 。
(2)仪器a的名称是 ,其作用是 。
(3)产品中除了有未反应的Na2SO3,外,最可能存在的无机杂质是 ,检验是否存在该杂质的方法是 。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因: 。
Ⅱ.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉做指示剂,用0.1000mol/L碘的标准溶液滴定,反应原理为
2S2O32-+I2=S4O62-+2I-。
(1)滴定至终点时,溶液颜色的变化: 。
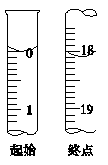
(2)滴定起始和终点的液面位置如图,则消耗点的标准溶液体积为 mL,产品的纯度为(设的相对分子质量为M) 。
Ⅲ.Na2S2O3的应用
Na2S2O3还原性较强,在溶液中易被氯气氧化成硫酸根离子,常用作脱氧即,该反应的离子方程式为 。



 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:  (g) =
(g) =  (g)+H 2(g) Δ
(g)+H 2(g) Δ  (g)+2HI(g) ③ Δ
(g)+2HI(g) ③ Δ  )在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数
)在刚性容器内发生反应③,起始总压为10 5Pa,平衡时总压增加了20%,环戊烯的转化率为________,该反应的平衡常数 
 ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。 





 粤公网安备 44130202000953号
粤公网安备 44130202000953号