【化学——选修3:物质结构与性质】
E、G、M、Q、T是五种原子序数依次增大的前四周期元素。E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子。请回答下列问题:
(1)与T同区、同周期元素原子价电子排布式是 。
(2)E、G、M均可与氢元素形成氢化物,它们的最简单氢化物在固态时都形成分子晶体,其中晶胞结构与干冰不一样的是 (填分子式)。
(3)E、G、M的最简单氢化物中,键角由大到小的顺序为 (用分子式表示),其中G的最简单氢化物的VSEPR模型名称为 ,M的最简单氢化物的分子立体构型名称为 。
(4)EM、GM+、G2互为等电子体,EM的结构式为(若有配位键,请用“→”表示) 。E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因 。
(5)TQ在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方TQ晶体结构如下图所示,该晶体的密度为ρ g·cm-3。如果TQ的摩尔质量为M g/mol,阿伏加德罗常数为NA mol-1,则a、b之间的距离为 cm。

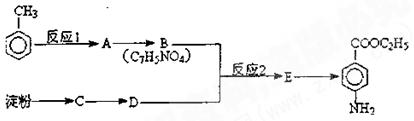
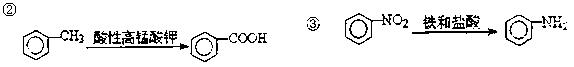
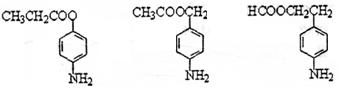
 色发生变化所用去的时间来判断空气中的含汞量,其反应为:
色发生变化所用去的时间来判断空气中的含汞量,其反应为: 粤公网安备 44130202000953号
粤公网安备 44130202000953号