金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。

请回答下列问题。
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C===2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为______;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为_________。
(2)上述生产流程中加入铁屑的目的是___________。此时溶液中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
| 氢氧化物 |
Fe(OH)2 |
TiO(OH)2 |
Mg(OH)2 |
| Ksp |
8.0×10-16 |
1.0×10-29 |
1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.001 8 mol/L,当溶液的pH等于________时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为____________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为_______。Mg还原TiCl4过程中必须在1070 K的温度下进行,你认为还应该控制的反应条件是_______。除去所得金属钛中少量的金属镁可用的试剂是______。
(4)在800~1 000 ℃时电解TiO2也可制得海绵钛,装置如下图所示。

图中b是电源的________极,阴极的电极反应式为________。
 消耗KMnO4溶液b mL。
消耗KMnO4溶液b mL。
 ~3次一并转入其中。
~3次一并转入其中。 定反应过程中所放出的热量可计算中和热。试回答下列问题。
定反应过程中所放出的热量可计算中和热。试回答下列问题。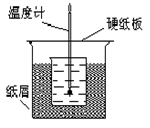
 粤公网安备 44130202000953号
粤公网安备 44130202000953号