能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);右图表示某次合成实验过程中甲醇的体积分数
CH3OH(g);右图表示某次合成实验过程中甲醇的体积分数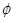 (CH3OH)与反应温度的关系曲线,则该反应的△H 0。(填“>、<或=”下同)
(CH3OH)与反应温度的关系曲线,则该反应的△H 0。(填“>、<或=”下同)
(2)若在230℃时,平衡常数K=1。若其它条件不变,将温度升高到500℃时,达到平衡时,K 1。
(3)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的 倍。
(4)利用甲醇燃料电池设计如图所示的装置:
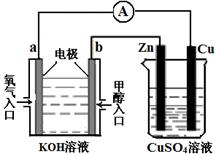
①则该装置中b为 极。
②当铜片的质量变化为12.8 g时,a极上消耗的O2 在标准状况下的体积为 L。
(5)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)="=" C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)="=" C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方为 。
 [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式:。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式:。
 YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol
YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol
 粤公网安备 44130202000953号
粤公网安备 44130202000953号