结合下表回答下列问题(均为25℃时的数据)
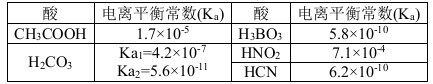
(1)上述五种酸中,酸性最强的是 (填化学式)。HCO3-的电离平衡常数表达式K= 。
(2)已知硼酸(H3BO3)与足量NaOH溶液发生酸碱中和反应的离子方程式为:H3BO3+ OH-= B(OH)4-, 则硼酸为 元酸,硼酸的电离方程式为 。
(3)常温下,0.01 mol·L-1的HNO2溶液加水稀释的过程中,下列各项数据增大的是 (填代号)。
①c(H+ ) ②c (NO2- )/ c(H+) ③Ka(HNO2)
④c(H+ )/ c(HNO2) ⑤c(OH -) ⑥
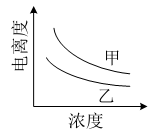
(4)右图描述的是醋酸与HNO2在水中的电离度与浓度关系,其中反映醋酸的是曲线 (填“甲”或“乙”,已知:电离度=已电离的溶质分子数/原有溶质分子总数) 。
(5)根据表中提供的数据可知,在溶液中能大量共存的微粒组是 (填代号)。
| A.H2CO3、HCO3-、 CH3COO-、CN- | B.HCO3-、 CH3COOH、CN-、CO32— |
| C.HCN、 HCO3-、CN-、CO32— | D.HCN、 HCO3-、CH3COO-、CN- |
(6)设计一个现象明显、操作简便的实验方案证明HNO2酸性强于碳酸(不用叙述仪器和具体操作)。
 和
和
 与足量NaOH溶液反应:。
与足量NaOH溶液反应:。 )的反应:。
)的反应:。 粤公网安备 44130202000953号
粤公网安备 44130202000953号