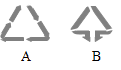呵护生存环境,共建和谐社会。
(1)2010年10月世界气候大会在坎昆召开,各国共商大计,控制温室气体的排放,下列属于温室气体的是 (填序号)。
① SO2 ② CO2 ③ N2
(2)自行车的部分构件有:①钢圈 ②轮胎 ③车灯外壳。其中属于合金的是 ;属于有机合成材料的是 (每空只填一种构件的序号)。
(3)废旧的钢圈、轮胎应投入如图所示 (填“A”或“B”)标志的垃圾桶中。
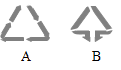
呵护生存环境,共建和谐社会。
(1)2010年10月世界气候大会在坎昆召开,各国共商大计,控制温室气体的排放,下列属于温室气体的是 (填序号)。
① SO2 ② CO2 ③ N2
(2)自行车的部分构件有:①钢圈 ②轮胎 ③车灯外壳。其中属于合金的是 ;属于有机合成材料的是 (每空只填一种构件的序号)。
(3)废旧的钢圈、轮胎应投入如图所示 (填“A”或“B”)标志的垃圾桶中。