(16分)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上常用CO和H2反应生产CH3OH,并开发出甲醇燃料电池。
(1)已知:CO(g)+1/2O2(g)=CO2(g)△H=-283.0 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1453.0 kJ·mol-1
则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)工业上常利用反应CO(g)+2H2(g)≒CH3OH(g)△H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。
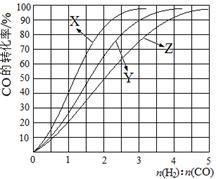
230℃的实验结果所对应的曲线是 (填字母);该温度下工业生产适宜采用的合成气组成n(H2):n(CO) 的比值范围是 (填字母)。
A.1~1.5 B.2.5~3C.3.5~4.5
(3)制甲醇所需要的氢气,可用下列反应制取:H
2O(g)+CO(g)

H
2(g)+CO
2(g) △
H<0,某温度下该反应的平衡常数
K=1。试回答下列问题:
①该温度下,若起始时
c(CO)="1" mol·L
-1,
c(H
2O)="2" mol·L
-1,反应进行一段时间后,测得H
2的浓度为0.5 mol·L
-1,则此时该反应
v(正)
v(逆)(填“>”、“<”或“=”)。
②若降低温度,该反应的
K值将
(填“增大”、“减小”或“不变”)。
(4)某实验小组设计了如图所示的甲醇燃料电池装置。
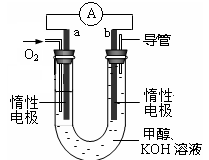
①该电池工作时,OH
-向
极移动(填“a”或“b”)。
②工作一段时间后,测得溶液的pH减小,该电池负极反应式为
,电池总反应的离子方程式为
。