某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟内不变色。
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。

(4)根据下列数据:请计算待测盐酸溶液的浓度为 mol/L
| 滴定次数 |
待测液体积(mL) |
标准NaOH溶液读数记录(mL) |
|
| 滴定前读数 |
滴定后读数 |
||
| 第一次 |
20.00 |
0.40 |
20.40 |
| 第二次 |
20.00 |
4.00 |
24.00 |
| 第三次 |
20.00 |
2.00 |
24.10 |
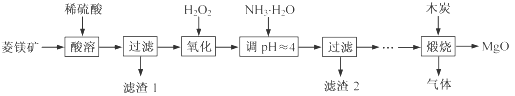
 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑







 粤公网安备 44130202000953号
粤公网安备 44130202000953号