I.常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
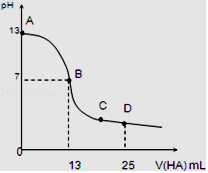
(1)写出MOH的电离方程式:__________________
(2)MOH与HA恰好完全反应时,溶液呈________性(填“酸”、“碱”或“中”),理由是(用离子方程式表示):________________________________________________。
(3)D点时,溶液中c(A﹣)+c(HA)__________2c(M+)(填“>”、“<”或“=”).
II.室温下,几种物质的溶度积常数见下表:
| 物质 |
Cu(OH)2 |
Fe(OH)3 |
CuI |
| Ksp |
2.2×10-20 |
2.6×10-39 |
1.3×10-12 |
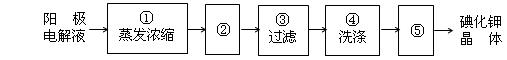
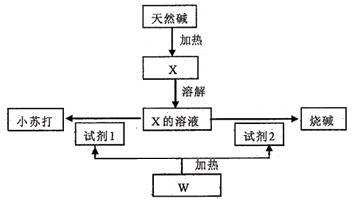
(1)室温下,某酸性CuCl2溶液中含少量的FeCl3,为得纯净CuCl2溶液,宜加入__________调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=__________________
(2)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(杂质不与I―发生氧化还原反应)的纯度,过程如下:取试样溶于水,加入过量KI固体,充分反应,有白色沉淀(CuI)产生。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液V mL。(已知:I2+2S2O32- S4O62-+2I―。)
S4O62-+2I―。)
①CuCl2溶液与KI反应的离子方程式为______________________________。
②可选用________作滴定指示剂,滴定终点的现象是:滴入最后一滴Na2S2O3,________________。
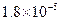 ,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=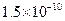
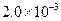 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示: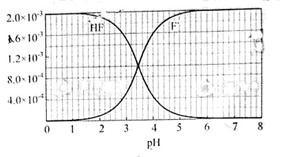
 ,列式并说明得出该常数的理由。
,列式并说明得出该常数的理由。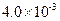 mol·L-1HF溶液与
mol·L-1HF溶液与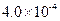 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。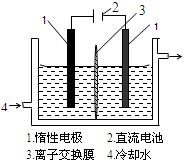
 2NH3△H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为C(N2)="0.100mol/L," C(H2)=0.300mol/L进行反应时, N2的浓度随时间的变化如下图①、②、③曲线所示。
2NH3△H<0。某实验室在三个不同条件的密闭容器中,分别加入浓度均为C(N2)="0.100mol/L," C(H2)=0.300mol/L进行反应时, N2的浓度随时间的变化如下图①、②、③曲线所示。
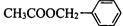 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下: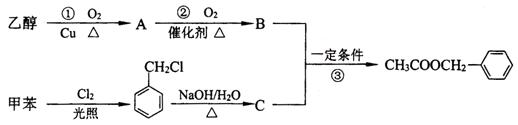
 粤公网安备 44130202000953号
粤公网安备 44130202000953号