工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g) Si(s)+4HCl(g);△H=+Q kJ·mol-1(Q>0)。某温度、压强下,将一定量的反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g);△H=+Q kJ·mol-1(Q>0)。某温度、压强下,将一定量的反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
| A.反应达平衡后,若压缩容器的体积,则SiCl4的转化率增大 |
| B.若反应开始时投入1mol SiCl4、2mol H2,则达到平衡时吸收热量为Q kJ |
| C.若反应4min HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol·(L·min)-1 |
| D.当反应吸收热量为0.025 Q kJ时,则生成的HCl全部通入100mL1mol·L-1的NaOH溶液中恰好反应 |
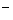 )
)
 =" 4" OH
=" 4" OH Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O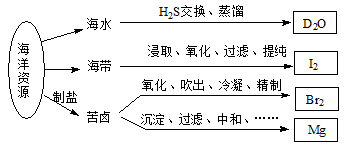
 H2O可转变为D2O
H2O可转变为D2O 与氦原子电子层结构相同,Y原子核外L层电子数为8且Y与X同主族,Z原子的最外层电子数是内层电子总数的一半,W的最高正价与最低负价的代数和为4,下列说法正确的是
与氦原子电子层结构相同,Y原子核外L层电子数为8且Y与X同主族,Z原子的最外层电子数是内层电子总数的一半,W的最高正价与最低负价的代数和为4,下列说法正确的是 粤公网安备 44130202000953号
粤公网安备 44130202000953号