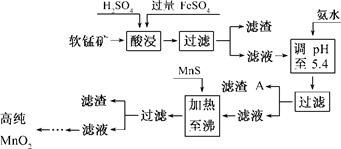
工业上接触法制硫酸过程中,在沸腾炉中煅烧硫铁矿(主要成分为FeS2)的化学方程式为:4 FeS2 + 11O2  2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
请回答下列问题:
(1)已知S为 -1价,则被氧化的元素是 。
(2)若煅烧1.0 t的硫铁矿(杂质含量为30%,杂质中不含硫元素),且FeS2的转化率为90%,则标准状况下,生成的SO2体积为 m3。
(3)若硫铁矿煅烧不充分,则炉渣中混有+2价的铁元素,试设计一个简单的实验证明之。简述实验操作和有关的实验现象 。
供选择的试剂:CuSO4溶液、稀硫酸、KMnO4溶液、品红溶液、NaOH 溶液等
(4)炉渣经提纯可制得FeCl3,电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路版。请写出FeCl3溶液与铜反应的化学方程式 。检验反应后的溶液中存在Fe3+的试剂可用 。欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,下列试剂中,需要用到的一组是(填字母) 。
①蒸馏水 ②铁粉 ③浓硝酸 ④稀盐酸 ⑤浓氨水 ⑥氯水
| A.①②④⑥ | B.①③④⑥ | C.②④⑤ | D.①④⑥ |

 粤公网安备 44130202000953号
粤公网安备 44130202000953号