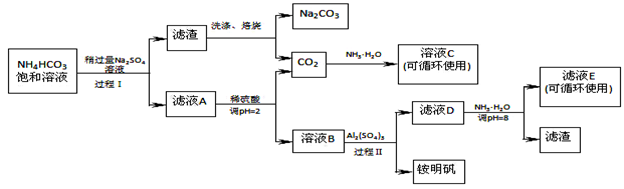
利用工厂的废铁屑(含少量Fe2O3、SiO2、锡等),制备绿矾(FeSO4·7H2O)的过程如下:

已知:①室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
②溶液X加KSCN不显红色。
(1)操作I的名称为 ,所需玻璃仪器为_______________。
(2)操作III的顺序依次为: 、冷却结晶、过滤、 、干燥。
(3)操作 II 中,试剂 Y 是_______,然后用稀硫酸将溶液酸化至 pH="2" 的目的是 。
(4)写出绿矾与酸性高锰酸钾溶液反应的离子方程式 。
(5)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至 pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
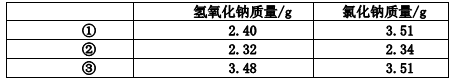
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论。

 Cu+2NO2↑+O2↑,用试管收集一试管气体并倒立于盛水的水槽中,写出气体溶解的化学反应方程式 ,并判断液体 (填“能”“不能”)充满整个试管(假定倒吸进试管的液体不流出)。
Cu+2NO2↑+O2↑,用试管收集一试管气体并倒立于盛水的水槽中,写出气体溶解的化学反应方程式 ,并判断液体 (填“能”“不能”)充满整个试管(假定倒吸进试管的液体不流出)。

 OH—+H3O+,则液态NH3电离的方程式是 ,液态N2O4电离得到电子数相差18的阴阳离子,因此可用Cu与液态N2O4反应制备无水硝酸铜,则同时生成的另一种物质为 。
OH—+H3O+,则液态NH3电离的方程式是 ,液态N2O4电离得到电子数相差18的阴阳离子,因此可用Cu与液态N2O4反应制备无水硝酸铜,则同时生成的另一种物质为 。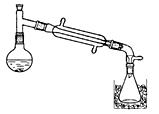

 粤公网安备 44130202000953号
粤公网安备 44130202000953号