A、B、C、D、E为原子序数递增的短周期元素,在周期表中A是原子半径最小的元素,B、C左右相邻,C、D同主族,D和E的气态氢化物具有相同的电子数,C的单质只有氧化性。
(1)写出实验室制取E2反应的离子方程式_______________________________;
(2)A、C元素按原子个数比为1:1形成化合物的电子式_________________;
(3)某小组设计如图所示的装置(图中夹持和加热装置略去),分别研究DC2和E2的性质.
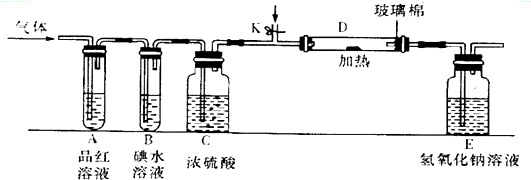
①分别通入DC2和E2,在装置A中观察到的现象是否相同(填“相同”或“不相同”)________;若装置D中装的是铁粉,当通入E2时D中观察到的现象为____________;若装置D中装的是五氧化二钒,当通入DC2时,打开K通入适量C2,化学反应方程式为________________________________。
②若装置B中装有5.0mL l.0×10-3mol/L的碘水,当通入足量E2完全反应后,转 移了5.0×10-5mol电子,则该反应的化学方程式为_______________________________。
(4)某同学将足量的DC2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母)_________,可以看到白色沉淀生成;
A、氨水 B、稀盐酸 C、稀硝酸 D、氯化钙
(5)若由元素D和C组成一2价酸根Z,Z中D和C的质量比为D:C=4:3,当E2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化铡溶液,有白色沉淀产生.与出E2与Z的溶液完全反应产生浅黄色沉淀的离子方程式______________________________。
(6)A、B、C三种元素组成的碱性物质N,A、B、C、D和一种常见金属元素组成相对分子质量为392的化合物M,1molM中含有6mol结晶水,对化合物M进行如下实验:
a.取含有0.1molM的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和4.48L(标况)无色刺激性气味气体,经一段时间白色沉淀变为灰绿色,最终变为红褪色;
b.另以含有0.1molM的溶液,加入过量BaCl2溶液产生46.6g白色沉淀,加盐酸沉淀不溶解。
①M的化学式为____________________________。
②在25℃下,测定浓度均为amol/L的化合物N和M的混合溶液pH=7,且含金属离子的浓度为bmol/L,则溶液里除H+、金属阳离子外的阳离子浓度为__________mol/L。




 粤公网安备 44130202000953号
粤公网安备 44130202000953号