A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大。A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1 ="578" kJ/mol,I2="1" 817 kJ/mol,I3=" 2" 745 kJ/mol,I4 ="11" 575 kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34。请回答下列问题:
(1)AY2是一种常用的溶剂,为 分子(填“极性”或“非极性”),分子中存在 个σ键。
(2)X形成的单质与NaOH溶液反应的离子方程式为 ,超高导热绝缘耐高温纳米XB在绝缘材料中应用广泛,其晶体与金刚石类似,属于 晶体。B的最简单氢化物容易液化,理由是 。
(3)X、氧、B元素的电负性由大到小的顺序为 (用元素符号作答) 。
(4)Z的基态原子核外电子排布式为 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2, HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示不正确的是 (填序号)
①氧化剂是O2
②HO2在碱中不能稳定存在
③氧化产物是HO2
④1 mol Z参加反应有1 mol电子发生转移
(5)已知Z的晶胞结构如下图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为 cm。ZYO4常作电镀液,其中YO42-的空间构型是 ,Y原子的杂化轨道类型是 杂化。




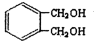 的同分异构体中同时符合下列条件的芳香族化合物,试写出其中一种的结构简式。
的同分异构体中同时符合下列条件的芳香族化合物,试写出其中一种的结构简式。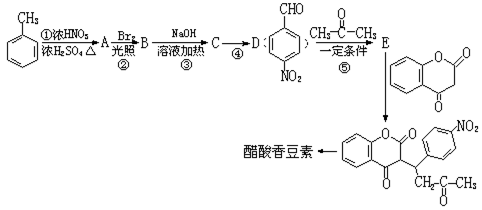

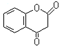 互为同分异构体且同时符合下列条件的有机物的结构简式为。
互为同分异构体且同时符合下列条件的有机物的结构简式为。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号