毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

(1)毒重石用盐酸浸取前需充分研磨,目的是 ;
直接蒸干BaCl2溶液 (填“能”或“不能”)得到BaCl2·2H2O晶体。
(2)
| |
Ca2+ |
Mg2+ |
Fe3+ |
| 开始沉淀时的pH |
11.9 |
9.1 |
1.9 |
| 完全沉淀时的pH |
13.9 |
11.1 |
3.2 |
加入NH3·H2O调节pH=8可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是_____________________________。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+===Cr2O72-+H2O Ba2++CrO42-===BaCrO4↓
步骤Ⅰ 移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。BaCl2溶液的浓度为________mol·L-1。
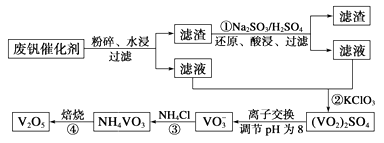

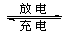 VO2++H2O+V3+,电池充电时阳极的电极反应式为。
VO2++H2O+V3+,电池充电时阳极的电极反应式为。
 CH3CH2Br + H2O
CH3CH2Br + H2O
 粤公网安备 44130202000953号
粤公网安备 44130202000953号