(1)2.00g C2H2气体完全燃烧生成液态水和CO2气体,放出99.6kJ的热量,写出表示C2H2燃烧热的热化学方程式_________________________。
(2)已知下列反应的反应热:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g) =CO2(g) △H2=-393.5 kJ/mol
③H2(g)+1/2O2(g)=H2O(l) △H3=-285.8kJ/mol
计算下列反应的反应热:
2C(s)+2H2(g)+O2(g)= CH3COOH(l) ΔH=____(写出计算结果)
(3)已知:
CH4(g)+ 2O2(g)= CO2 (g) + 2H2O (l) △H= -Q1 kJ/mol
2H2(g)+O2(g)= 2H2O(g) △H= -Q2 kJ/mol
2H2(g)+O2(g)= 2H2O(l) △H="-" Q3 kJ/mol
取体积比4:1的甲烷和氢气的混合气体11.2L(标况),经完全燃烧恢复至常温,放出的热量为 _________。
(4)请认真观察右图,然后回答问题。

①图中反应是 (填“吸热”或“放热”)反应,该反应 (填“需要”或“不需要”)环境先提供能量。
②已知热化学方程式:H2(g)+1/2O2(g) === H2O(g) △H= -241.8kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为 。
 要的作用。以下每小题中的电池即为广泛使用于日常生活、生产和科学技术等方面的实用电池,请根据题中提供的信息,填写空格。
要的作用。以下每小题中的电池即为广泛使用于日常生活、生产和科学技术等方面的实用电池,请根据题中提供的信息,填写空格。 为:
为:

 热制取乙烯。
热制取乙烯。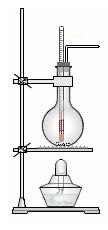
 插入反应溶液液面下,以便控制温度
插入反应溶液液面下,以便控制温度 可用可不用)。
可用可不用)。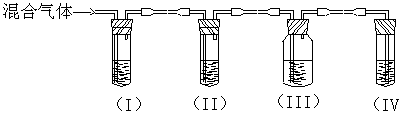
 ;II;III;IV。
;II;III;IV。 粤公网安备 44130202000953号
粤公网安备 44130202000953号