根据题干要求回答下列问题
(1)用系统命名法给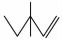 命名为:_________________;写出该物质与HBr反应的化学方程式:_________________
命名为:_________________;写出该物质与HBr反应的化学方程式:_________________
(2)2丁烯合成聚2丁烯的方程式为:_________________________
(3)实验室制乙烯的反应方程式:______________________________
2-甲基-1,2-丁二醇的催化氧化方程式: __________________________
根据题干要求回答下列问题
(1)用系统命名法给 命名为:_________________;写出该物质与HBr反应的化学方程式:_________________
命名为:_________________;写出该物质与HBr反应的化学方程式:_________________
(2)2丁烯合成聚2丁烯的方程式为:_________________________
(3)实验室制乙烯的反应方程式:______________________________
2-甲基-1,2-丁二醇的催化氧化方程式: __________________________