条件的探索一直是化学工业的重要课题,现有如下两种合成氨的途径:
I. N2(g)+3H2(g) 2NH3(g)△H=-90.0kJ/mol
2NH3(g)△H=-90.0kJ/mol
II. 2N2(g)+6H2O(l) 4NH3(g)+3O2(g)△H=+1530.0kJ/mol
4NH3(g)+3O2(g)△H=+1530.0kJ/mol
(1)根据上述反应,写出表示H2燃烧热的热化学方程式 。
(2)在恒温恒容的甲容器、恒温恒压的乙容器中分别进行合成氨反应如图(图中所示数据均为初始物理量)
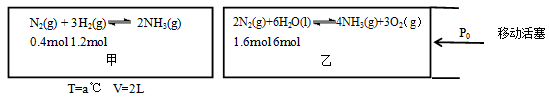
反应均达到平衡时,生成NH3也均为0.4mol(忽略水对压强的影响及氨气的溶解)
①该条件下甲容器中的K= ;平衡时,甲的压强P平= (用P0表示);
②该条件下,若向乙中继续加入0.2mol N2,达到平衡时N2转化率= ;
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如下图所示。
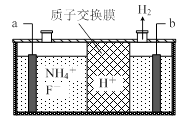
a电极为电解池的 (填“阴”或“阳”)极,写出该电极的电极反应式: 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。已知N2O4(g) 2NO2,N2O4、NO2共存的温度是264K-413K,低于熔点264K时,全部为无色的N2O4晶体,达到264K时,N2O4开始分解,沸点294K时,成为红棕色的混合气体。
2NO2,N2O4、NO2共存的温度是264K-413K,低于熔点264K时,全部为无色的N2O4晶体,达到264K时,N2O4开始分解,沸点294K时,成为红棕色的混合气体。
①25℃,101KPa下,在1L密闭容器中,发生反应N2O4(g) 2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;
2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;
②0℃,101KPa下,在1L密闭容器中,发生反应N2O4(g) 2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;(填上相应字母)
2NO2,已达平衡状态。若此时再向其中加入4.6g纯NO2,则再次达平衡时混合物的颜色比原平衡 ;(填上相应字母)
a.加深 b.变浅 c. 不变 d.无法判断
(5)难溶电解质FeS在水溶液中存在着溶解平衡:FeS(s) Fe2+(aq) + S2-(aq),在一定温度Ksp=c(Fe2+)·c(S2-)=6.25×10-18;在该温度下,氢硫酸饱和溶液中存在c2(H+)· c(S2-)=1.0×10-22。将适量FeCl2投入氢硫酸饱和溶液中,欲使溶液中c(Fe2+)="1.0" mol·L-1,应调节溶液的pH= (已知lg2=0.3)
Fe2+(aq) + S2-(aq),在一定温度Ksp=c(Fe2+)·c(S2-)=6.25×10-18;在该温度下,氢硫酸饱和溶液中存在c2(H+)· c(S2-)=1.0×10-22。将适量FeCl2投入氢硫酸饱和溶液中,欲使溶液中c(Fe2+)="1.0" mol·L-1,应调节溶液的pH= (已知lg2=0.3)
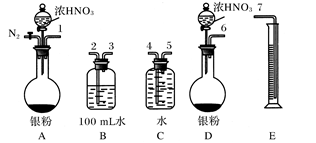
 (4)用如上图所示的实验装置可精制粗溴。
(4)用如上图所示的实验装置可精制粗溴。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号