如图所示是有关氧气的性质实验.
(1)在这三个反应中有许多共同特点,如 (请你叙述其中1个共同点即可);实验操作必须正确规范,请叙述上述实验中1个注意事项 ,其目的是 .
(2)请写出其中1个反应的文字表达式(或化学方程式) ;通过上述实验后,你能得出的结论是 .
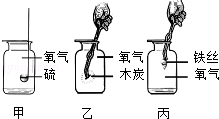
如图所示是有关氧气的性质实验.
(1)在这三个反应中有许多共同特点,如 (请你叙述其中1个共同点即可);实验操作必须正确规范,请叙述上述实验中1个注意事项 ,其目的是 .
(2)请写出其中1个反应的文字表达式(或化学方程式) ;通过上述实验后,你能得出的结论是 .
