常温下,向100 mL 0.01 mol/L HA溶液中逐滴加入0.02 mol/L MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。下列说法中,不正确的是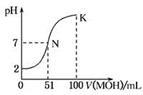
| A.HA为一元强酸 |
| B.MOH 为一元弱碱 |
| C.N点水的电离程度小于K点水的电离程度 |
| D.若K点对应溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)="0.005" mol/L |
常温下,向100 mL 0.01 mol/L HA溶液中逐滴加入0.02 mol/L MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。下列说法中,不正确的是
| A.HA为一元强酸 |
| B.MOH 为一元弱碱 |
| C.N点水的电离程度小于K点水的电离程度 |
| D.若K点对应溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)="0.005" mol/L |