蓄电池是一种反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应如下:NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)此蓄电池在充电时,电池负极应与外加电源的_____极连接,电极反应式为_____________。
(2)以铜为电极,用此蓄电池作电源,电解以下溶液,开始阶段发生反应:
Cu+2H2O===Cu(OH)2+H2↑的有______________。
| A.稀H2SO4 | B.NaOH溶液 | C.Na2SO4溶液 | D.CuSO4溶液 E.NaCl溶液 |
(3)假如用此蓄电池电解以下溶液(电解池两极均为惰性电极),工作一段时间后,蓄电池内部消耗了0.36 g水。试回答下列问题:
①电解足量N(NO3)x溶液时某一电极析出了a g金属N,则金属N的相对原子质量R的计算公式为R=____________(用含a、x的代数式表示)。
②电解含有0.1 mol·L-1的CuSO4溶液100 mL,阳极产生标准状况下的气体体积为________L;将电解后的溶液加水稀释至2L,溶液的pH=_____。
(4)熔融盐燃料电池是以熔融碳酸盐为电解质、CH4为燃料、空气为氧化剂、稀土金属材料为电极的新型电池。已知该熔融盐电池的负极的电极反应是:CH4-8e-+4 CO=5CO2+2H2O,则正极的电极反应式为_______________________。
(5)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-a kJ·mol-1;
CH3OH(g)===CH3OH(l) ΔH=-b kJ·mol-1;
2H2(g)+O2(g)===2H2O(g) ΔH=-c kJ·mol-1;
H2O(g)===H2O(l) ΔH=-d kJ·mol-1。
则表示CH3OH(l)燃烧热的热化学方程式为 。
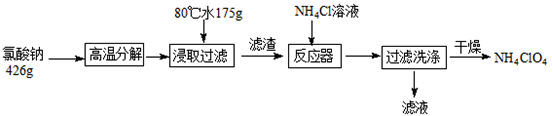
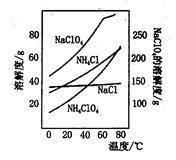
 N2↑+2O2↑+Cl2↑+4H2O,,现可提供下列试剂:
N2↑+2O2↑+Cl2↑+4H2O,,现可提供下列试剂: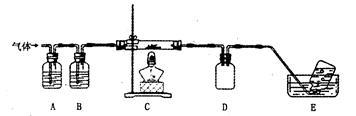






 粤公网安备 44130202000953号
粤公网安备 44130202000953号