氧化还原反应是化学反应中的基本反应之一,研究氧化还原反应,对人类的进步 具有极其重要的意义。
I.某化学兴趣小组为探究Ag+和Fe3+氧化性,设计了如下实验:
第一步:将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。
第二步:为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用的试剂:KSCN溶液、酸性KMnO4溶液、氯水。请完成下表:
| 操 作 |
现象 |
结论 |
| 取少量除尽Ag+后的溶液于试管中,加人KSCN溶液,振荡 |
(1) |
存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入 (2) ,振荡 |
(3) |
存在Fe2+ |
【实验结论】Fe的氧化产物为Fe2+和Fe3+,氧化性:Ag+ Fe3+(填“大于”或“小于”)。
Ⅱ.生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
(1)NaCl和Cl2中化学键的类型分别是 和 。
(2)燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
Ⅲ.将32 g铜与l40 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①待产生的气体全部释放后,向溶液加入V mL amol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。(用含V、a的式子表示)
②欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要H2O2的质量为 g。
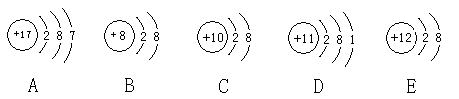
 2Fe(s)+3CO2(g)ΔH>0
2Fe(s)+3CO2(g)ΔH>0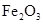 粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为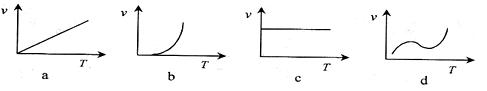
 +4)制取纳米级TiO2的流程如下:
+4)制取纳米级TiO2的流程如下: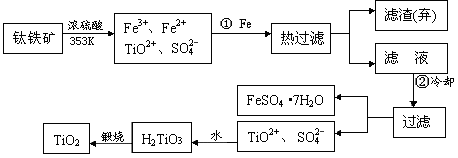
 TiCl4
TiCl4 Ti
Ti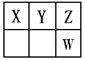
 ,
, CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为。
CO2+ H2达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为。
 CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表: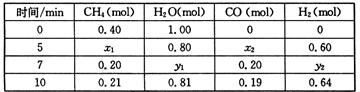
 粤公网安备 44130202000953号
粤公网安备 44130202000953号